LECCIÓN 38. Calor. -Hipótesis acerca de su naturaleza. -Teoría dinámica. -Efectos generales del calor. -Medida de las temperaturas. -Termómetros. -Termómetro de mercurio. Diferentes escalas termométricas.
231. Calor. -Hipótesis acerca de su naturaleza. -Bajo la denominación de fluidos incoercibles e imponderables se conocen aún ciertos agentes físicos de materia sutilísima y sin peso, que al obrar sobre los cuerpos dan origen a todos los fenómenos: son esos fluidos, además de la atracción, el calórico, el lumínico, el magnetismo y la electricidad. De aquí que la palabra calórico haya servido y aún sirve en la actualidad según algunos, para indicar la causa de los fenómenos del calor, si bien según la nueva doctrina que hoy domina en la Física, el calor, que ha sido considerado durante mucho tiempo como un fluido particular y misterioso, de naturaleza desconocida y que origina las sensaciones de calor o de frío;40 que hace hervir los líquidos y funde los metales, no es más que resultado del movimiento vibratorio de las moléculas de los cuerpos. En efecto, conocidos en todos tiempos los fenómenos del calor, hanse ideado muy diversas hipótesis para explicar la causa que los origina y entre todas ellas, dos principalmente se han disputado el predominio en la ciencia. La hipótesis de la emisión o de las emanaciones y la hipótesis de las vibraciones u ondulaciones.
A. Hipótesis de la emisión. -Este sistema patrocinado por Newton, Laplace y otros sabios, admite que la causa del calor es un fluido material, pero imponderable o sin peso, llamado calórico, que está continuamente emitiéndose o emanándose de los cuerpos y que pasa de unos a otros, con velocidad extraordinaria, a través del espacio en línea recta y cuyas moléculas materiales están dotadas de una gran fuerza de repulsión. Según esta hipótesis un cuerpo que emite mucho calor se enfría. Esta teoría que también se ha aplicado a los fenómenos de la luz, ha sido abandonada, porque es ineficaz para explicar ciertos hechos, principalmente luminosos, como no sea atribuyendo nuevas y muy diversas propiedades, además de las conocidas, a esos agentes físicos; y no explica en manera alguna los fenómenos del magnetismo y de la electricidad, como lo hace la hipótesis de las vibraciones.
B. Hipótesis de las vibraciones. -La exposición científica y racional de los principios en que descansa esta hipótesis, débese al genio analítico y pensador del gran Descartes;41 confirmada más tarde y sobre todo en la época actual, por los magníficos trabajos y descubrimientos de numerosos sabios. Esta teoría, sencilla en su fundamento, es la más racional, la que explica perfectamente todos los fenómenos, ¿habiendo uno solo de que no dé razón satisfactoria, cumpliendo así con la condición lógica de toda hipótesis.
El calor, en esta hipótesis, es resultado del movimiento vibratorio rapidísimo de las moléculas de los cuerpos; allí, pues, donde una molécula vibre o se conmueva por el frotamiento o por otra causa, se desarrolla calor, tanto más intenso, cuanto más rápido sea el movimiento molecular: esto es un hecho evidente y en él no aparece la hipótesis. Pero para explicar cómo ese calor desarrollado por la acción del movimiento de las moléculas, trasmite por el espacio y pasa de unos cuerpos a otro, penetrando en su interior, se supone la existencia de una materia sutilísima, perfectamente elástica, esparcida en todo el universo y que se, halla lo mismo, en el vacío, que en el interior de todos los cuerpos, aún los más compactos, cuya sustancia se llama éter o materia etérea. Al vibrar, pues, un cuerpo, vibra también el éter que tiene en su interior, produciendo, ondas que se propagan por el espacio con una amplitud y por lo tanto alcanzando una extensión proporcional al impulso recibido; y según sea esa amplitud o su rapidez, así origina calor, luz o electricidad. He aquí la hipótesis que además de explicar con gran facilidad todos los efectos del calor, tiene la ventaja de que también da razón de los fenómenos de la luz y de la electricidad y con ella desaparece esa fuerza llamada acción a distancia que nada significa y de que tendremos ocasión de hablar. En esta hipótesis todo se explica por movimientos de la materia y de aquí el nombre que también lleva de teoría dinámica, que aplicada al calor se llama más particularmente teoría termo-dinámica.42
232. Teoría dinámica del calor. -Partiendo del principio fundamental de que el calor es producto del movimiento molecular, hubo necesidad de estudiar en qué se convierta ese calor cuando desaparecía en los cuerpos. Esa desaparición es aparente; pues el calor al cesar en sus efectos se trasforma en movimiento, así como el movimiento se convierte en calor, de modo que existe una relación constante entre un determinado trabajo específico y el calor necesario para producirlo y viceversa, lo cual constituye el equivalente mecanismo del calor (295). He aquí, pues, que todo fenómeno de calor es una consecuencia de la comunicación o trasformación del movimiento y recíprocamente.
233. Efectos generales del calor. -El primer efecto que produce el calor al desarrollarse en los cuerpos es el de dilatarles y hacerlos cambiar de estado. La dilatación no es más que la separación de las moléculas de los cuerpos y por consecuencia el aumento de volumen. Si la dilatación crece consecuencia, de la mayor cantidad de calor, los cuerpos pueden cambiar de estado, es decir, pasar de sólidos a líquidos o gases y viceversa si el calor disminuye, en cuyo caso las moléculas se contraen y el cuerpo se reduce a menor volumen.
234. Dilatación. -Todos los cuerpos se dilatan por el calor; siendo los más dilatables los gases y los menos los sólidos. En estos últimos se consideran dos clases de dilatación, la lineal y la cúbica: por la primera aumenta el cuerpo en longitud o en una sola dimensión y por la segunda en volumen. Demuéstrase que los sólidos sa dilatan longitudinalmente por medio de un aparato (fig. 124) en el que se fija la barra que se va a ensayar por el extremo A, apoyándose el otro extremo B en el brazo de una aguja que puede girar en un semicírculo graduado: un depósito cilíndrico que se halla debajo de la barra tiene una mecha empapada en alcohol que se enciende apenas la barra se calienta, se dilata y hace que la aguja vaya corriendo por las divisiones del cuadrante. La dilatación cúbica o en volumen se demuestra por medio del aparato llamado anillo de S'. Gravessande43 que consiste (fig. 125) en un anillo metálico por el cual pasa casi rasando a la temperatura ordinaria una esfera de metal: si ésta se calienta, aumenta de volumen y ya no pasa por el anillo.
Que los líquidos y los gases se dilatan o contraen por el aumento o disminución de calor, lo comprueban los aparatos de que vamos a hablar.
235. Termómetros. -Llámase temperatura la cantidad de calor sensible que posee un cuerpo: si esa cantidad aumenta o disminuye se dice que la temperatura sube o baja. Los aparatos destinados a medir las temperaturas, reciben el nombre de termómetros (del griego termos calor y metron medida). Cuatro clases se conocen de termómetros: 1.ª termómetros propiamente dichos que sirven para temperaturas ordinarias: 2.ª termóscopos que aprecian cantidades pequeñas de temperatura de dos lugares próximos: 3.ª termómetros de máxima y mínima temperatura, que dan a conocer el mayor o menor grado de calor que adquiere un cuerpo o un espacio durante un período de tiempo determinado y 4.ª pirómetros que indican las más altas temperaturas.
236. -Termómetro. -La invención de este utilísimo instrumento se debe a Drebbel44 que lo dio a conocer a principios del siglo XVII, aunque algunos le atribuyen al ilustre Galileo: de todos modos, fue en un principio muy imperfecto, pero perfeccionado posteriormente y tal como se conoce en el día, se construye con líquidos, que se dilatan un término medio entre los sólidos y los gases. Entre ellos se da la preferencia al mercurio y al alcohol; el primero, porque es metal que se dilata con regularidad, no moja el tubo y resiste sin gasificarse temperaturas bastante elevadas; aunque no sirve para temperaturas muy bajas o grandes fríos, porque se solidifica y, sus dilataciones son ya irregulares; para esos casos se emplea el alcohol teñido de rojo, que no se solidifica consiste el termómetro en un tubo de vidrio, capilar, terminado por un extremo en un depósito esférico o cilíndrico, a veces en espiral con mercurio o alcohol y una escala que indica lo que el líquido se dilata o contrae. Por lo tanto la construcción de un termómetro comprende tres operaciones: 1.º elección del tubo: 2.º introducción del líquido y 3.º la graduación. -Estudiaremos estos detalles en el termómetro de mercurio.
A. Tubo termométrico. Ha de estar bien calibrado, es decir ha de tener el mismo diámetro en toda su extensión, pues de lo contrario las divisiones iguales de la escala, no corresponderán a iguales dilataciones del mercurio. Conócese que un tubo está calibrado, introduciendo en su interior un índice o pequeña columna de mercurio y haciéndole recorrer toda la extensión del tubo, si el índice tiene la misma longitud en todo el trayecto, el tubo está calibrado. Entonces por procedimientos que no son de este lugar, se forma en su extremo un depósito esférico o cilíndrico, mejor cilíndrico y en el otro se suelda una especie de embudo.
B. Introducción del mercurio. -Colocando mercurio en una especie de embudo, se calienta por la parte inferior, el aire se dilata y en parte sale por el embudo, entonces obrando la presión atmosférica, obliga al mercurio a penetrar dentro del tubo: se repite la operación hasta que el depósito y una porción del tubo estén llenos de mercurio; calentándole de nuevo hasta que el líquido produzca vapores que expulsen todo el aire y la humedal, se quita el embudo y reblandeciendo por el calor el extremo del tuba, se cierra.
C. Graduación. -La escala que se hizo de fijar en el tubo para conocer las variaciones de calor, es preciso que tenga dos puntos fijos, que representen temperaturas constantes. Estos dos puntos de partida son la temperatura de la fusión del hielo y el punto de ebullición del agua: el primero corresponde al cero y el segundo se ha convenido quo represente 100. Para determinar el punto cero se introduce el tubo del termómetro en una vasija que contenga hielo machacado; el mercurio se contrae y en el punto donde quede estacionario, se pone una señal con una tirita de papel y representa el cero. Para obtener el otro punto extremo de la escala se pone el tallo termométrico suspendido dentro de una caja de latón en cuya parte inferior hay una vasija con agua que se hace hervir; los vapores rodean todo el depósito del termómetro y parte del tubo, el mercurio se dilata y el punto en que se estacione se pone otra señal que indica el punto 100. Una circunstancia hay que tener presente en la determinación de este último punto, y es que la presión atmosférica hace variar el grado de ebullición de los líquidos si el agua hierve a los 100 grados, es bajo la presión de 760mm por lo tanto, si en el momento de la operación el barómetro no señala esa altura es preciso hacer una, pequeña corrección. La experiencia nos dice que por cada 27mm que sube o baja el barómetro, el grado de calor de la ebullición aumenta o disminuye, de consiguiente por cada 27mm o parte de ellos que el barómetro señale sobre los 760, se aumenta en la escala un grado o fracción de grado y viceversa. Respecto a la pureza del agua nada influye, pues aunque hierva a mayor temperatura que 100 grados, por las sustancias que pueda tener en disolución, sus vapores tienen siempre 100 grados de calor.
El espacio que media entre el cero y 100, se divide en 100 partes iguales que se llaman grados, continuando la graduación por encima del 100. Y por debajo del cero: los primeros se llaman grados sobre cero y los segundos bajo cero; estos últimos se representan en la escritura anteponiendo el signo menos (-); así -5º quiere decir 5 grados bajo cero. Los grados sobre cero no necesitan signo. Esta escala se graba, en una plancha de madera o metal donde se coloca el tubo termométrico; pero es preferible grabarla en el mismo vidrio, como se hacen con los termómetros de precisión, pues además de que el vidrio se dilata poco por lo mismo las divisiones de los grados permanecen casi invariables, permite introducirle en líquidos que pudieran atacar el metal o la madera.
237. Diferentes escalas termométricas. No todos los termómetros llevan la escala que acabamos de describir: Conócense tres muy diferentes; la escala centígrada, debida a Celsio45 que es la anteriormente dicha y la usada más generalmente por estar acorde con el sistema métrico-decimal: la de Reamur46 y la de Fahrenheit. La primera está dividida en 100 partes, la segunda en 80, es decir, el cero corresponde también a la fusión del hielo, como en la anterior, pero en el punto de ebullición del agua, donde Celsio colocó 100, puso Reamur 80; y la tercera tiene ambos puntos diferentes. El cero de esta escala la halló Fahrenheit en el frío producido por una mezcla, en partes iguales en peso, de sal amoniaco y nieve, en cuya mezcla los termómetros anteriores señalan 32 bajo cero; y en el punto de ebullición del agua puso 180, siendo el total de su escala 212 (fig. 126). De, aquí resulta que 80 grados R equivalen a 100 de C y viceversa y por lo mismo un grado de R equivale a
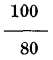
o

de C; y un grado C es igual a
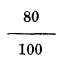
o
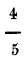
de grado de R. También 100.ºC equivalen a 212 menos 32, o sean 180 de F, y un grado C vale
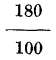
de F, y un grado C vale
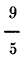
de F; y un grado F es igual a
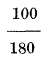
o
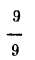
de C
Y por último 80.º R equivalen a 212-32 o 180 de F; siendo un grado R igual a
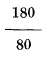
o
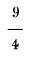
F y uno de F a
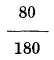
o
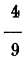
de R
Cuando los termómetros R y C marcan 0.º Fahrenheit señala 32 sobre cero.
Muchas veces interesa reducir unas escalas a otras y la operación es muy sencilla. Se quiere reducir grados R a C o al contrario; se comparan las escalas entre sí y el número de grados que se dan con el que se desea saber: sea por ejemplo 30 grados R a C;
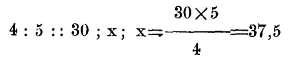
sean ahora los 375 C a R;

Sean grados F a C, por ejemplo 122, se empieza por restar 32 para que el cero corresponda a la escala centígrada y se procede como en los casos anteriores;
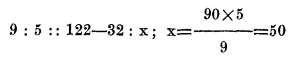
Para la misma reducción de F a R;

Por último los grados C o R se reducen a F del modo siguiente; practicadas las operaciones se añaden los 32.º que tiene la escala F sobre las otras dos
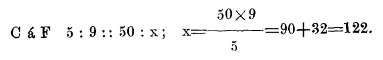

Resumiendo: para reducir,
a. -Grados R a C se multiplican por

b. -R a F se multiplican por

y al producto se añaden

c.-C a F se multiplican por

y al producto se añaden
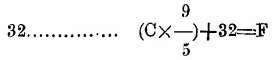
d. -C a R se multiplica por
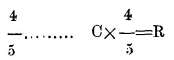
e. -F a R se rebajan 32 y el resto se multiplica por
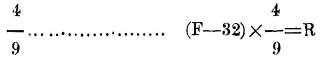
f. -F a C se rebajan 32 y el resto se multiplica por
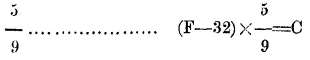
Cuando son muchas y continuas las reducciones que hay que hacer, como acontece con las observaciones que se efectúan en las Estaciones meteorológicas, con objeto de evitar este trabajo y abreviar el tiempo, los Anuarios de los observatorios traen tablas en las que ya está hecha la reducción.
LECCIÓN 39. Termómetro de alcohol. -Cero absoluto de calor. -Cambio de posición del cero. -Límites de temperatura de los termómetros de mercurio y alcohol. -Termómetro diferencial de Leslie. -Termóscopos. de máxima y mínima temperatura. -Termómetro metálico. -Pirómetros.
238. Termómetro de alcohol. -Este termómetro bastante usado, pero que no ofrece las ventajas y exactitud que el de mercurio, sólo se diferencia de éste en el líquido que es alcohol teñido de ojo. Se llena como el anterior y se gradúa por comparación con otro tipo de mercurio. Pero como el alcohol hierve a los 79º, la escala sólo se prolonga sobre el cero hasta los 60 o 65 grados; pero bajo cero puede extenderse todo lo que permita el tubo, pues el alcoho1 se contrae hasta indicar las temperaturas más bajas.
a Termómetro clínico. -Así se llama un termómetro cuyo depósito se aplica a ciertas regiones del cuerpo como la axila o sobaco, para deducir de su temperatura, comparada con la normal u ordinaria del cuerpo humano, el estado febril de un enfermo. La de mercurio y el depósito se halla libre, pero el tubo está dentro de otro de cristal, en el cual se encuentra la escala trazada con tinta en una tira de papel para así distinguir los grados más fácilmente.
239. Cero absoluto. -El cero de las escalas termométricas es solamente relativo, pues el cero real o absoluto sería la carencia completa de calor, es decir, según la hipótesis de las vibraciones, el estado de reposo absoluto de las moléculas de un cuerpo. Este cero no se halla aún bien determinado, o a lo menos sólo se conoce de una manera hipotética.
240. Cambio de posición del cero. -El termómetro mejor construido pasado algún tiempo no rige bien, pues si se introduce en hielo fundente ya no señala el cero, es decir que el mercurio no desciende hasta ese grado; de consiguiente ese punto extremo de la escala cambia de posición o se encuentra más elevado. Este fenómeno ha sido explicado de muy varia manera; la más aceptable es la que supone que el vidrio cuando ha sido muy calentado, al enfriarse repentinamente adquieren sus moléculas un estado anormal y al volver lentamente a su estado primitivo, la capacidad del depósito disminuye. Por eso para, observaciones exactas es preciso rectificar la posición del cero, si el termómetro hace tiempo que está construido.
241. Límites de temperatura en los termómetros de mercurio y alcohol. -Como el mercurio no hierve hasta los 350º y no se solidifica hasta -39º, parece que entre estos dos límites debiera servir este termómetro: sin embargo, la observación ha comprobado que solo entra los -36º y 100 se dilata con regularidad, no ofreciendo fuera de estos puntos, el termómetro de mercurio; exactitud en sus indicaciones. Respecto al de alcohol sólo puede usarse para temperaturas que no pasen de 35º, pero para las inferiores, sirve aún en las más bajas, pues hasta el día no se ha podido solidificar con los fríos mas intensos. No obstante, solidificándose el agua, que contiene se pone espeso y ya no rige por cuya razón se aconseja por algunos, sustituir el alcohol por el súlfido carbónico o el éter.
242. Termómetro diferencial de Leslie47.- Como su nombre lo indica empléase este termómetro para conocer la diferencia de temperatura de dos puntos próximos. Consta este aparato (fig. 127) de un tubo de vidrio dos veces encorvado hacia la parte superior en ángulo recto, terminando sus ramas en dos esferas. Contiene ácido sulfúrico teñido de rojo hasta la mitad de las ramas y el resto y las esferas contienen aire. Cuando este gas tiene la misma temperatura e igual tensión en ambas esferas, el líquido se halla a la misma altura en una y otra, en cuyo punto se señala cero: si ahora se introduce una de las esferas en agua a la temperatura de 10º y la otra en hielo fundente, el aire de la primera se dilata, hace descender el líquido en esta rama y se eleva en la otra, los puntos donde permanecen fijas las columnas líquidas se pone 10: se divide el espacio re cero y 10, en diez partes iguales, y se continúa la división por encima y por debajo.
243. -Termóscopo de Rumford. -Otro termómetro diferencial, que se llama más particularmente termóscopo de Rumford48, difiere solo del de Leslie (fig. 128) en que es mayor la rama horizontal y más grandes las esferas: además el líquido está reducido a un pequeño índice de un centímetro de longitud, que cuando se halla en la parte media de la rama horizontal, señala en cada uno de sus extremos el cero y se gradúa como el anterior. Si una de las esferas tuviera mas aire que la otra, se inclina el aparato para que el índice líquido vaya a un apéndice de vidrio situado en uno de los ángulos del tubo; equilibrado el aire, se hace que el índice vuelva a su posición.
244. Termómetros de máxima y mínima temperatura. -No siendo fácil estar observando el termómetro continuamente durante un día, para conocer cuando llega a la más alta o la más baja temperatura, se han ideado aparatos que ellos mismos indican y dejan señalado el mayor ascenso o el menor descenso. De aquí los termómetros de máxima temperatura al sol y a la sombra y de mínima temperatura.
A. Termómetro de máxima temperatura al sol. -Es de mercurio y se construye de muy diversa manera. El de Rutheford es un termómetro colocado horizontalmente (fig. 129) que lleva delante de la columna de mercurio un pequeño índice de hierro Dilatándose el líquido por la acción del calor empuja el índice y le hace caminar hasta que el mercurio deja de dilatarse; al descender la temperatura el mercurio se contrae, pero el índice permanece en el punto hasta donde había llevado indicando la temperatura más alta a que se elevó el mercurio. Hecha la observación, se inclina el termómetro para que el índice vuelva a ponerse en contacto con el mercurio.
B. Termómetro de máxima temperatura a la sombra. En el mismo termómetro anterior con la sola diferencia de su colocación fuera de la acción del s 1.
Estos aparatos ofrecen varios inconvenientes por cuya razón en el día, en la mayor parte de los Observatorios meteorológicos, se usan los construidos por el inglés Casella, por el sistema del Dr. Phillips. El de máxima sol tiene el depósito, que es esférico, de vidrio negro para que absorba más fácilmente los rayos directos del sol; y el de sombra en el estado natural del vidrio. En uno y otro el índice está formado por una pequeña columna de mercurio que no se une a la general por hallarse entre las dos una pequeñísima burbuja de aire: cuando el mercurio se dilata, empuja la columna y al contraerse aquel queda el índice estacionario indicando hasta donde se elevó la temperatura.
C. Termómetro de mínima temperatura del aire. -Se construye con alcohol: está colocado también horizontalmente y resguardado de la irradiación nocturna (fig. 130). Lleva dentro del alcohol un pequeño índice de esmalte a. Si se halla éste en el extremo de la columna líquida, pero dentro de ella y la temperatura desciende, el líquido se contrae y arrastra consigo el índice por efecto de la adhesión; si después el calor aumenta, el alcohol se dilata y pasa sin mover el índice por entre éste y el vidrio, señalando así aquel, el punto a donde descendió la temperatura. Para una nueva observación se inclina el instrumento hasta que el índice vuelva al extremo de la columna líquida. También ha construido Casella un termómetro de mínima con mercurio, cuyos detalles y manejo no corresponden a estos estudios.
D. Termómetro de mínima temperatura para la irradiación nocturna. Este termómetro llamado también reflector es de alcohol con el depósito ennegrecido y funciona como los ordinarios de mínima.
245. Termómetro metálico. -Un termómetro curioso y notable por su gran sensibilidad ha construido Breguet49. Está fundado en la desigual dilatación de los metales, plata, oro y platino. Se compone de una cinta finísima arrollada en espiral y formada por los tres metales perfectamente soldados (fig. 131). El oro se halla en el centro, la plata que es el metal más dilatable en el exterior y el platino, el menos, en el interior de la hélice. Fija ésta por un extremo, el otro queda libre y lleva una aguja que corre en un cuadrante. Este aparato se gradúa por comparación. Cuando la temperatura aumenta, como la plata se dilata mas que el platino, se desarrolla la hélice y la aguja corre en el cuadrante; y si el calor disminuye, arrollándose mas la hélice la aguja se desvía en sentido contrario.
246. Pirómetros. -Se llaman así (del griego pir fuego y metron medida) los instrumentos que sirven para medir altas temperaturas. Los pirómetros que generalmente se describen en esta clase de obras, ofrecen poca precisión y solo pueden usarse otros, para cuyo estudio se necesitan como cimientos de que se hablará más adelante. El pirómetro descrito en casi todos los tratados elementales de Física, por más que no ofrezca seguridad en sus indicaciones, es el de Wedgwood50, que está fundado en la propiedad que tiene la arcilla dé contraerse por la elevación de temperatura. Consta (fig. 132) de dos reglas metálicas que forman entre sí un ángulo pequeño, cuya mayor abertura, donde está el cero, el; de 12mm'5 y la menor de 8mm'5. Un cilindro de arcilla penetra a la temperatura ordinaria hasta el cero: si este cilindro se coloca por ejemplo, dentro de un horno de fundición, se contrae y entonces puede avanzar más en la menor abertura del ángulo que forman las reglas, señalando el grado de calor; teniendo en cuenta que el cilindro de arcilla a la temperatura ordinaria, se supone que corresponde a 500º y que cada grado del pirómetro representa 72º del termómetro centígrado.
LECCIÓN. 40. -Dilatación de los cuerpos sólidos. -Coeficientes de dilatación. -Aplicaciones de la dilatación de los sólidos. -Péndulos de compensación.
247. Dilatación de los sólidos. -Coeficientes de dilatación. -Sabemos lo que se entiende por dilatación y de cuantas maneras se considera o sea la dilatación lineal o de una dimensión cúbica o en volumen. Llámase coeficiente de dilatación lineal, el aumento que toma la unidad de longitud de un cuerpo, cuando pasa su temperatura de 0º a 1 grado, o aumenta lº, entre 0 y 100; y coeficiente de dilatación cúbica, el aumento que en las mismas condiciones adquiere la unidad de volumen. Estos coeficientes varían para los diferentes cuerpos, pero para uno mismo hay entre ellos una relación muy simple, cual es que el coeficiente de dilatación cúbica es triplo del coeficiente de dilatación lineal. En efecto, sea un cubo cuyo lado valga uno a la temperatura de 0º si llamamos d al aumento por dilatación que toma este lado al elevarse su temperatura a 1 grado, tendremos que su longitud valdrá ahora 1+d y por consecuencia el volumen del cubo será (1+d)3; de donde
(1+d)3 = 1+3d+3d2+d3
Pero el aumento d o sea el coeficiente es una cantidad pequeñísima, luego su cuadrado y su cubo serán cantidades aun más pequeñas que pueden despreciarse, quedando pues reducida la anterior igualdad a (1+d)3=l+3d.
Luego para conocer los coeficientes de dilatación de un cuerpo basta averiguar uno de ellos, pues conocido el lineal se obtiene el cúbico, multiplicando por 3 o conocido éste se tiene el lineal dividiendo por 3.
A. Determinación del coeficiente de dilatación lineal. -Entre los muchos aparatos y procedimientos propuestos para determinar este coeficiente describiremos el ideado por Lavoisier51 y Laplace. Una caja rectangular de cobre se halla colocada sobre un hornillo entre cuatro columnas de piedra; dentro de ella se coloca la barra cuyo coeficiente de dilatación se desea averiguar, de tal modo que por un extremo se halla fuertemente apoyada en P, (como puede verse en sección que representa la fig. 133) y por el otro está en contacto con un eje R, que lleva un anteojo horizontal que puede girar con su pié o eje y dirigir la visual a las divisiones de una regla, colocada a 200 metros de distancia. Puesta la barra en la caja y rodeada de hielo se observa con el anteojo a qué división de la escala corresponde: hecho esto se pone agua o aceite en la caja y se calienta, la barra se dilata por el extremo libre m, empuja el eje del anteojo y cuan do la temperatura queda estacionaria, se observa la del baño por medio de un termómetro y a qué división de la regla corresponde la nueva posición del anteojo. Con estos datos se determina la dilatación de la barra y de ella se deduce el coeficiente. En la posición que adquirió el anteojo cuando la barra se ha dilatado, con relación a la que tenía cuando la barra se hallaba a 0º, resultan los dos triángulos 0mn y 0AB que son semejantes por tener sus lados respectivamente perpendiculares; de modo que
mn : AB :: Om : OA
luego la dilatación
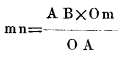
Y que la razón de la dilatación de la barra a la desviación del anteojo es constante, lo demuestra el que para otra prolongación cualquiera mn', la desviación sería A B' y por lo mismo
mn: AB' :: Om: OA
luego también en este caso es igual al cociente de

En las experiencias de Lavoisier y Laplace el valor de esta razón era igual a

por lo tanto
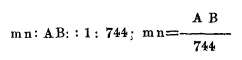
luego la dilatación se obtiene dividiendo por 744 la distancia recorrida por el anteojo sobre la regla. Si esta dilatación total de la barra se divide por la longitud de ésta a cero y por la temperatura del baño, se tendrá la dilatación de una unidad a un solo grado, es decir el coeficiente de dilatación lineal.
Coeficientes de dilatación de varios cuerpos.
- Vidrio blanco 0.000'008
- Platino 0.000'009
- Acero 0.000'010
- Hierro fundido 0.000'011
- Hierro forjado 0.000'012
- Oro 0.000'014
- Cobre 0.000'017
- Bronce 0.000'018
- Plata 0.000'019
- Estaño 0.000'021
- Plomo 0.000'028
248. Aplicaciones. -La dilatación de los cuerpos sólidos y muy principalmente de los metales ofrece numerosas aplicaciones. Los herreros para colocar las llantas o aros de hierro a las ruedas hacen uso de esta propiedad. Construido el aro de un diámetro un poco mas pequeño que la rueda, se calienta casi hasta enrojecerlo y dilatado se acomoda en la circunferencia de la rueda; introduciéndola luego repentinamente en agua fría, se contrae y oprime fuertemente los radios de la rueda. Las barras, que forman las rejillas de los hornillos, los rails de los caminos de hierro etc., no se tocan ni sujetan por sus dos extremos, sino que se dejan libres para que al dilatarse, por el aumento de calor, puedan extenderse, sin romperse o encorvarse, y si bien la dilatación de los metales es muy pequeña para un grado de calor y una unidad de longitud dadas, puede llegar a ser muy grande si es considerable la longitud del metal. Tal sucede en las barras-carriles de las vías férreas: así por ejemplo, la línea de Badajoz a Lisboa tiene un longitud de 271 kilómetros o 271000 metros; si la oscilación de la temperatura entre el invierno y el verano es de 50º, siendo el coeficiente de dilatación del hierro forjado entre 0º y 100º de 0.000'012, entre 0 y 50º será de 0'0006, luego la dilatación puede llegar a ser de 271000 x 0'0006=126m'6.
Pero la principal y más importante aplicación de este fenómeno, es a la compensación de los péndulos.
249. Péndulos compensadores. -Hemos visto (95) que para que un péndulo produzca siempre en el mismo tiempo iguales oscilaciones, es necesario que la longitud permanezca invariable; de ese modo el isocronismo no se altera y puede servir de regulador en los relojes. Pero hemos visto también (97) que la intensidad de la gravedad hace variar la duración de las oscilaciones, de modo que un reloj construido en Londres, cuyo péndulo bata segundos, no los producirá en Badajoz, sino se disminuye su longitud; al efecto los péndulos terminan en su parte inferior en tornillo en donde una tuerca puede hacer bajar o subir la lenteja y los relojes de bolsillo llevan una palanca que oprime o ensancha el muelle que hace de péndulo. Pero no basta que se cumpla esta circunstancia porque esa longitud en el mismo lugar de la tierra no permanece invariable, pues dilatándose o contrayéndose la varilla por la acción del calor, varía a cada momento su longitud. Para evitar este inconveniente es preciso compensar los péndulos: dícese que un péndulo de un reloj está, compensado o tiene compensación, cuando el amento en longitud que adquiere la varilla por la elevación de temperatura se halla contrarrestado por otro aumento o dilatación en sentido contrario. Varios sistemas se han propuesto para lograr este objeto.
A. Sistema Le Roi. -Este método ideado a fines del pasado siglo, consiste (fig. 134) en una serie de varillas, alternadamente de acero y latón: la varilla central que está fija en el travesaño superior y atraviesa libremente el inferior, sostiene la lenteja. Si el número de varillas es doble, lo es también el de travesaños. Aumentando la temperatura, las varillas de acero se dilatan hacia abajo y hacen que aumente la longitud en una cantidad determinada, pero las de latón se prolongan hacia arriba en la misma cantidad y por lo tanto la longitud de la varilla que sostiene la lenteja permanece constante.
B. Sistema Grahan. -Este péndulo (fig. 135) bastante usado por los constructores ingleses, fue inventado por este mecánico del siglo XVIII52. Consiste en una varilla de acero que lleva en lugar de lenteja uno o dos vasos de vidrio sostenidos por una guarnición también de acero, que contienen mercurio en cuyo centro de gravedad se halla el de oscilación. Al dilatarse la varilla hacia la parte inferior tiende a descender el centro de oscilación y la longitud aumenta en una cantidad dada; pero el mercurio se dilata hacia la parte superior y hace ascender el centro de oscilación en la misma cantidad, conservándose así inalterable la longitud.
C. Sistema Harrison.53 -El método de compensación propuesto por este constructor consiste en un mecanismo muy sencillo. Dos láminas de cobre y hierro soldadas y que llevan en sus extremos dos esferas metálicas, se hallan fijas en la varilla del péndulo, (fig. 136) estando la hoja de cobre que es más dilatable debajo de la de hierro. Aumentando la temperatura la varilla se dilata y la lenteja desciende, pero las láminas también se dilatan encorvándose hacia la parte superior por dilatarse más el cobre que el hierro y elevándose las esferas A y B, si su masa está bien calculada, hay compensación entre los puntos de la varilla que tienden a alejarse del centro de suspensión y los que se acercan a él: lo contrario sucede si disminuye la temperatura, en cuyo caso las láminas encorvándose hacia la parte inferior tienden a tomar la forma A' B'.
D. Compensación del volante de los relojes. -Una compensación parecida a la anterior ha sido aplicada a la compensación de los relojes de bolsillo, cuyo regulador es un volante con un resorte en espiral. Dos pequeñas láminas de plata, oro y platino en forma de arco se hallan sujetas por un extremo al volante y el otro termina en una esferita de oro (fig. 137). Con el calor el volante se dilata, pero la plata exterior de los arcos, dilatándose también, los encorva más y acerca las esferas al centro: la longitud, pues, permanece la misma y la amplitud de la oscilación constante.
LECCIÓN 41. Dilatación de los líquidos. -Coeficiente de dilatación de los líquidos. -Máximum de densidad del agua. -Dilatación de los gases. -Coeficiente de dilatación de los gases. -Densidad de los gases.
250. Dilatación de los líquidos. -En los líquidos sólo se consideran dilataciones cúbicas o en volumen, pero como estos cuerpos se hallan siempre contenidos en vasijas y éstas también se dilatan, aunque menos que los líquidos, es preciso tener presente esta dilatación; de aquí la división de la dilatación de los líquidos en real o absoluta y aparente. La primera es el aumento que adquiere un cuerpo líquido, independiente de la dilatación del vaso que le contiene o suponiendo que éste no se dilata y la segunda es el aumento que adquiere el líquido dentro de la vasija teniendo en cuenta que ésta también se dilata. La dilatación absoluta es mayor que la aparente en una cantidad igual a lo que se dilata la vasija. Compruébase esto último introduciendo en una vasija que contenga agua hirviendo un tubo (fig. 138) terminado en un depósito con alcohol teñido de rojo hasta la altura a: tan pronto como ha penetrado el depósito en el agua el nivel de éste desciende hasta b, lo cual prueba que las paredes de la vasija se han dilatado, pero al poco tiempo y cuando ya el líquido se ha calentado, se dilata y asciende una cantidad igual a su dilatación real más la de la vasija.
251. Coeficiente de dilatación absoluta del mercurio. -Importa mucho conocer el coeficiente de dilatación absoluta del mercurio por las numerosas aplicaciones que tiene este cuerpo. Este coeficiente ha sido determinado por diversos procedimientos, lográndose evitar la influencia de la dilatación de la vasija con el propuesto por los Sres. Dulong54 y Petit. Estos físicos fundaron su método en el principio de hidrostática que dice que las alturas de los líquidos en vasos comunicantes, están en razón inversa de sus densidades (118) y por lo mismo son independientes de la capacidad del vaso y por lo tanto de la dilatación. El aparato reducido a su mayor sencillez se compone de dos tubos de vidrio A y B (fig. 139) que comunican por otro capilar; rodea a cada tubo un cilindro de metal, hallándose el que envuelve a A con hielo y el de B con aceite que se calienta poco a poco los tubos contienen mercurio que está a la misma altura de nivel mientras la temperatura es igual en uno y otro, pero se eleva en el tubo B a medida que se calienta, porque entonces se hace menos denso: llamando a y a' a las alturas en A y B y d d' a sus densidades respectivas, tendremos que por el principio citado
a' : a :: d : d';
de donde
a' d' = a d (1)
Si se supone igual a 1 el volumen de la columna de mercurio a 0 grados o sea la del tubo A y que sea D su coeficiente de dilatación cúbica, la del tubo B será 1+Dt, y como la densidad de un cuerpo está en razón inversa de su volumen a medida que se dilata, resulta
d' : d :: 1: 1 + Dt
de donde
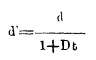
reemplazando el valor de d' en la igualdad (1) tendremos
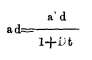
y por lo tanto

Medidas, pues, las alturas a y a' y conocida la temperatura t del tubo B dedujeron los físicos citados el coeficiente de dilatación del mercurio, que hallaron igual a
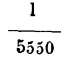
entre cero y 100º; observando además que crece con la temperatura y por lo tanto sólo es regular la dilatación entro los líquidos citados, lo cual acontece lo mismo con los demás líquidos.
252. Coeficiente de dilatación del vidrio. -Mucho interesa conocer el coeficiente de dilatación del vidrio para obtener el absoluto de los líquidos contenidos en vasijas de este cuerpo; habiéndose hallado el coeficiente de dilatación cúbica del vidrio por la diferencia entre los coeficientes del mercurio absoluto
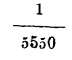
y aparente
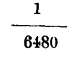
o sea

igual a 0'000026. El coeficiente de dilatación aparente de un líquido se determina por el procedimiento del termómetro de peso y se obtendrá el absoluto, añadiendo al aparente obtenido, el coeficiente de dilatación del vidrio.
A. Termómetro de peso. -Con este sencillo aparato se determina el coeficiente de dilatación aparente de los líquidos. Consiste en un depósito R grande y prolongado (fig. 140) que termina en un tubo capilar encorvado. Pesado, vacío y luego con el líquido, se calienta y el líquido que al dilatarse, se derrama se recoge en una cápsula; del peso de esta cantidad de líquido y de la temperatura dada se deduce el coeficiente de dilatación aparente. Llamando D a este coeficiente, p al peso del líquido derramado, P al peso del que queda en el aparato y t la temperatura;
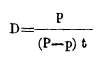
253. Máximum de densidad del agua. -Hemos visto que entre las numerosas aplicaciones que tiene el agua, es una el servir de término de comparación o unidad, para hallar el peso específico de los cuerpos sólidos y líquidos, debiendo emplearse en su máximum de densidad, que como ya dijimos es a la temperatura de 4º con la particularidad de que a partir de ese punto de calor, ya aumente o decrezca, la densidad de este líquido va disminuyendo, por lo cual el agua solidificada, o sea el hielo o la nieve, siendo menos densa que la líquida, flota en esta. Hoppe, físico escocés, fue el primero que determinó la mayor densidad del agua por medio del aparato (fig. 141) que consiste en una campana de vidrio con pie, que lleva dos termómetros exactamente iguales colocados horizontalmente en dos orificios uno superior y otro inferior y en la parte media un cilindro metálico en que se pone hielo. Llena de agua a 12º la campana, se puede ver que el termómetro inferior desciende rápidamente hasta 4º quedando en este punto mientras el superior empieza a bajar hasta cero, lo cual prueba que el agua, al enfriarse hasta 4º, se hace más densa y desciende; al paso que enfriándose más o sea hasta cero, se vuelve más ligera y asciende impresionando al termómetro superior.
254. Dilatación de los gases. -Coeficiente de dilatación. -Los gases son los cuerpos más dilatables y de dilatación más regular. El coeficiente de dilatación cúbica, único, que como en los líquidos se considera en estos cuerpos, se diferencia muy poco en los diversos gases. Gay Lussac fue el primero que halló el coeficiente de dilatación del aire. En una vasija rectangular de hoja de lata, colocada sobre un hornillo (fig. 142) está atravesado un tubo termométrico a b dividido en partes de igual capacidad lleno de aire seco, para lo cual colocado mercurio en el interior del tubo y un alambre fino de platino se calienta y agitando suavemente el mercurio con el alambre sale el líquido gota a gota, siendo reemplazado por el aire, que antes de penetrar en el termómetro pasa por un tubo unido a éste que contiene una sustancia que retiene muy fácilmente la humedad (cloruro de calcio) y se deja en el interior una pequeña cantidad de mercurio que va a servir de índice. Pónese en la caja hielo machacado y contrayéndose el aire arrastra el índice y se anota la división hasta donde ha llegado, cuando los termómetros A y B señalen cero grados, con lo cual se tiene el volumen a cero; quitando luego el hielo y reemplazándole con aceite se enciende el hornillo, la temperatura aumenta gradualmente, el aire del tubo se dilata, el índice avanza y se observa la división donde queda estacionado. Con estos datos y teniendo en cuenta la presión atmosférica en el momento de la experiencia, halló Gay-Lussac que el coeficiente de dilatación del aire era 0'00375. Otros flancos han hallado como coeficiente 0'00367 y las conclusiones siguientes:
1.ª Cada gas tiene un coeficiente diferente.
2.ª El coeficiente aumenta con la presión.
3.ª El aire tiene una dilatación constante, entre 0º y 350º.
255. Densidad de los gases. -Se llama así la relación entre el volumen del gas y otro volumen igual de aire ambos a la temperatura de cero y presión de 760. En principio, pues, el procedimiento para determinar la densidad de un gas, se reduce a emplear un globo de vidrio provisto de llave que se pesa primero vacío y sucesivamente lleno de aire y del gas en cuestión, uno y otro perfectamente secos. Deducido el peso del globo vacío, del obtenido en la otras dos pesadas, se tiene el peso del gas y del aire bajo el mismo volumen; dividiendo el primero por el segundo el cociente de la densidad del gas. Sin embargo como no es fácil que durante estas operaciones se halle la temperatura a cero y la presión a 760mm, es preciso hacer las correspondientes correcciones; algunas de las que se evitan con el método propuesto por Regnault, pero aún así el procedimiento exige varias experiencias delicadas. También puede suceder que el gas cuya densidad se quiera determinar, sea de los que atacan al cobre como el cloro, en ese caso no puede emplearse el globo de vidrio con llave de metal, sino un frasco de tapón esmerilado, cuya capacidad se averigua, pesándola luego llena de aire y después con el gas y hechas las correcciones de temperatura y presión se divide el peso del volumen de éste por el del aire y el cociente será el peso específico.
LECCIÓN 42. -Cambios de estado de los cuerpos. -Fusión. Sus leyes. -Calor latente. -Disolución. -Mezclas frigoríficas. -Solidificación. Sus leyes. -Cristalización. -Formación del hielo. Rehielo. -Causas que retardan la solidificación.
256. Cambios de estado de los cuerpos. -Hemos visto que los efectos generales del calor son dilatar todos los cuerpos y hacerlos cambiar de estado: rigurosamente el fenómeno es el mismo o el segundo es una consecuencia del primero. En efecto, tanto pueden dilatarse las moléculas de un cuerpo sólido que venciendo el calor a la fuerza de cohesión, el sólido se convierte en líquido y si el calor aumenta más las moléculas adquirirán la tenuidad que caracteriza a los gases y tomarán ese estado. El primer fenómeno se llama fusión, el segundo vaporización. Pero si el calor o la fuerza repulsiva disminuye, vuelve a superar la cohesión y el cuerpo deja el estado de vapor para convertirse en líquido; tal es la liquefacción y si se trasforma en sólido, el fenómeno se llama solidificación.
257. Fusión. Sus leyes. -Es, pues, la fusión el paso de un cuerpo del estado sólido al líquido por la acción del calor. No todos los cuerpos se funden o liquidan. Hasta ahora, quizás por falta de elevadas temperaturas, no ha podido fundirse el diamante y otras sustancias como las maderas, las telas, etc., antes se descomponen en sus elementos, que fundirse.
La fusión de los cuerpos obedece a tres leyes, que confirma la experiencia.
1.ª Todo cuerpo necesita un grado de calor determinado para fundirse.
2.ª Desde que principia la fusión hasta que termina, la temperatura no varía, sea cual fuere el foco de calor.
3.ª El punto de fusión de un cuerpo varía con la presión.
Esta ley es una consecuencia de la primera. Se ha observado que el punto de fusión aumenta con la presión, excepto en el agua sólida que disminuye su grado de fusión cuando la presión aumenta.
Grado de fusión de los cuerpos más importantes.
- Hielo 0
- Sebo 33
- Fósforo 44
- Potasio 55
- Estearina 60
- Cera 63
- Sodio 90
- Azufre 111
- Estaño 228
- Bismuto 264
- Plomo 335
- Zinc 412
- Plata 1000
- Cobre 1100
- Hierro 1200
- Oro 1250
- Acero 1350
- Platino 2000
258. Calor latente. -Según la 2.ª ley de la fusión, la temperatura del cuerpo que se está fundiendo no varía, mas no por eso deja de recibir calor que penetra en su masa y que convertido en fuerza viva, sino produce sus efectos sobre el termómetro y por consecuencia no se manifiesta de un modo sensible, está obrando en el interior de las moléculas, manteniéndolas en el estado de repulsión que necesitan para permanecer líquidas: este calor que así se oculta en el interior de la masa del cuerpo se llama calor latente de fusión. ¿Si pues no obra este calor sobre el termómetro, cómo se conoce su existencia? 1.º Por varias experiencias y 2.º porque cuando el cuerpo deja el estado líquido y se solidifica de nuevo, abandona ese calor y entonces se convierte en libre y afecta al termómetro. Una experiencia aclarará estos hechos. Si se mezcla un kilogramo de hielo con otro kilogramo de agua a 79º parecía natural que resultaran dos kilogramos a la temperatura de 39'5º y sin embargo la mezcla solo tiene la temperatura de cero grados; los 79º grados, pues, se han convertido en calor latente o se han empleado en elevar un grado la temperatura de un kilogramo de hielo.
El calor latente es distinto para cada cuerpo y su determinación se indicará más adelante. (295)
259. Disolución. -Cuando un cuerpo sólido desaparece, haciéndose en el seno de un líquido, se dice que se disuelve. Este fenómeno es una verdadera fusión y va, por lo tanto, acompañado de la absorción de calor, que el sólido, al licuarse, convierte en latente: tal se observa cuando el azúcar se disuelve en el agua, de quien toma calor que hace latente, enfriándola. A veces, sin embargo, la disolución no produce enfriamiento, sino que al contrario desarrolla calor, pero eso sucede cuando entre el sólido y el líquido hay afinidad química, pues en toda combinación, como veremos en Química, se desarrolla calor. Los cuerpos se disuelven más o menos en los líquidos, aumentando en general el poder disolvente, con el calor.
259 (bis) Mezclas frigoríficas. -Se llama así, la reunión o mezcla de diversas sustancias que producen fríos más o menos intensos. Originado este calor por la conversión del sensible en latente al pasar un sólido al estado líquido, se comprendo que cuando menos una de las sustancias de la mezcla frigorífica ha de ser sólida. Las sustancias que generalmente se emplean para formar mezclas frigoríficas son la nieve o el hielo y la sal común, que pueden producir un enfriamiento de -16º La explicación física del fenómeno es muy sencilla: en el caso anterior, por ejemplo, el hielo al licuarse, absorbe calor que hace latente y que toma de la vasija y del aire que la rodea; en esa agua líquida se disuelve la sal, la cual también absorbe calor que oculta en su masa, produciéndose por tanto en los dos hechos, desaparición de calor y por lo mismo frío.
Mezclas frigoríficas
| SUSTANCIAS | Partes en peso Enfriamiento que producen. |
| Hielo o nieve | 2 -16º |
| Sal común | 1 |
| Sulfato sódico | 3 -19º |
| Ácido nítrico diluido | 2 |
| Hielo o nieve | 3 -51º |
| Cloruro cálcico | 4 |
260. Solidificación. Sus leyes. -Solidificación es el paso de un cuerpo líquido al estado sólido por la disminución de temperatura. Cuando la solidificación se refiere al agua se llama más particularmente congelación. El fenómeno de la solidificación se halla sometido a dos leyes, recíprocas de las de fusión: 1.ª La solidificación de un cuerpo se verifica a una temperatura constante que es precisamente la de su punto de fusión Así el azufre se funde a 111º, es decir, que a partir de ese punto de calor, ascendiendo en la escala termométrica el azufre está líquido y desde los 111º 9 descendiendo su temperatura, aparece sólido. 2.ª Desde que principia la solidificación hasta que termina, la temperatura del cuerpo no varía. Esta ley es consecuencia del fenómeno del calor latente; pues el líquido al solidificarse tiende a enfriarse pero por cada grado que desciende su temperatura, desprende otro de calor latente que se convierte en sensible; el equilibrio se mantiene y la temperatura permanece estacionaria.
Como el calor dilata los cuerpos se comprende que disminuyendo han de contraerse, por eso por regla general los cuerpos que se solidifican disminuyen de volumen, excepción hecha del agua, el hierro y algunos otros.
Así como hay cuerpos que con dificultad se funden, así existen otros que difícilmente se solidifican: tal sucede al alcohol o espíritu de vino, que a lo sumo con muy bajas temperaturas de -100º se ha podido ponerle espeso.
261. Cristalización. -Si los cuerpos al solidificarse afectan una forma regalar o geométrica, se dice que cristalizan55 De esta definición se deduce, 1.º que no todos los cuerpos líquidos al convertirse en sólidos cristalizan, ejemplo la cera; 2.º que para cristalizar un cuerpo es preciso que se halle antes líquido, bien sea fundido o disuelto; aunque también algunos cuerpos como el arsénico y el alcanfor, pueden cristalizar cuando, del estado de vapor pasan directamente al sólido. La primera condición, pues, en que ha de hallarse un cuerpo para cristalizar, es una libertad completa en sus moléculas, para que al agruparse por la atracción la fuerza desconocida que determina la forma geométrica, pueda producir sus efectos: son además condiciones necesarias para que se realice la cristalización, tiempo, espacio y reposo; faltando alguna de ellas o la cristalización no se verifica o los cristales son diminutos o el cuerpo adquiere una forma geométrica que no es la que le corresponde.
262. Formación del hielo. -El agua en el estado sólido recibe el nombre genérico de hielo; aunque también es agua sólida la nieve, el granizo y la escarcha. La solidificación del agua se produce como ya hemos dicho a cero grados. El agua como algunos otros cuerpos (hierro, antimonio, bismuto) presenta la particularidad de ser más ligera en estado sólido que en el líquido, por el aumento de volumen que adquiere; este aumento que toma el agua al solidificarse origina el desarrollo de una fuerza expansiva extraordinaria, como lo demuestran varias experiencias. Llenas de agua algunas bombas, cerrado su orificio con un fuerte tapón de madera y colocadas en un recinto cuyo aire se hallaba a muchos grados bajo cero, se pudo observar que, como consecuencia de la congelación unas se agrietaron y en otras fue lanzado el tapón a gran distancia saliendo por el orificio una porción de hielo.
263. Rehielo. -Cuando dos trozos de hielo se ponen en contacto pueden soldarse, aún cuando floten en agua caliente. Este fenómeno singular recibe el nombre de rehielo. Varias hipótesis se han propuesto para explicarle: Tyndall56 dice que en la fusión de un trozo de hielo las moléculas exteriores están libres y no experimentan la acción coercitiva de las interiores, pero cuando están en contacto dos trozos las superficies que se tocan pasan a ser interior del cuerpo y no teniendo ya la libertad suficiente para fundirse se vuelven a helar o rehielarse, adquiriendo en consecuencia una tenacidad y fuerza extraordinarias. Este hecho ha servido de fundamento a la teoría de Tyndall para explicar la formación de la nieve compacta y dura, como una roca, que se encuentra en las regiones inferiores de los Alpes.
264. Causas que retardan la solidificación. -Aunque hemos indicado que los líquidos tienen un punto determinado de solidificación que es recíproco del de fusión, hay sin embargo causas que pueden retardar ese punto, llamándose sobrefusión al descenso de temperatura bajo el grado de solidificación de un líquido. Esas causas son 1.ª Las sustancias que tenga el líquido en disolución; así el agua del mar no se congela hasta -2, 5. 2.ª La falta de aire o de otro gas en disolución en el líquido; Gay-Lussac colocó una vasija con agua destilada en una mezcla frigorífica y puesto todo bajo la campana de la máquina neumática y expulsado el aire, descendió el agua hasta -12º sin solidificarse. 3.ª La completa inmovilidad del líquido; el azufre que se solidifica a 111º, permanece líquido hasta los 20º si se enfría lentamente y está en completo reposo. 4.ª La presión u otra causa cualquiera que impida a las moléculas agruparse libremente para tomar el estado sólido. Un cañón de acero en cuyo interior se coloca una bala y lleno completamente de agua, se cierra por medio de un tornillo de presión y colocado en una atmósfera de -12.º a -20º el agua se mantiene líquida como lo prueba el sonido de la bala al mover el cañón. La solidificación en este caso no se efectúa, porque el agua no puede dilatarse o aumentar de volumen por la presión a que está sometida. También el agua colocada en tubos capilares puede enfriarse hasta -20º sin solidificarse.
LECCIÓN 43. Vapores. -Evaporización. -Vapores en el vacío. -Espacio saturado. -Tensión del vapor de agua a diferentes temperaturas. -Tensión del vapor en espacios desigualmente calientes.
265 Vapores. -Evaporización. -Sabemos que por vapor se entiende el estado aeriforme en que se convierte un cuerpo líquido por la acción del calor. Los vapores proceden todos de cuerpos líquidos y de ahí la denominación de vapor de agua, vapor de éter, vapor de mercurio, etc. No todos los líquidos producen vapores; los que lo verifican se llaman volátiles, y los que no dan vapores, sino que antes se descomponen, se denominan fijos, como los aceites grasos. También hay cuerpos sólidos que pasan directamente al estado de vapor, sin antes liquidarse, tal es el alcanfor, el hielo, las materias olorosas, etc. El acto de pasar un cuerpo al estado de vapor, se llama en general evaporización, en la cual se distinguen dos casos: la evaporización lenta o espontánea, o sea cuando el vapor se produce lentamente en la superficie del líquido y sin foco directo de calor y la evaporación rápida, llamada también ebullición que es la producción rápida de vapor en toda la masa por la acción de un foco directo de calor. Los vapores tienen muchos de los caracteres de los gases, pero también se encuentran entre ellos algunas diferencias como veremos. Lo que caracteriza principalmente a los vapores, como a los gases es su fuerza elástica o de tensión. Demuéstrase esta fuerza en los vapores por medio de un tubo de vidrio en forma de sifón con la rama corta cerrada y con mercurio hasta la mitad (fig. 143). Se hace pasar a esta rama unas gotas de éter e introduciendo el tubo en una vasija que contenga agua caliente a 45º, se ve bajar el mercurio en la rama corta, hasta B por ejemplo, llenándose el espacio superior de un vapor cuya tensión obliga al mercurio a descender. Si el tubo se enfría, condensado el vapor disminuye su tensión y el mercurio se eleva de nuevo, por la presión de la atmósfera que obra sobre la rama mayor abierta y si nuevamente se calienta a mayor temperatura que antes, la tensión aumenta y el mercurio desciende mucho más.
266. Vapores en el vacío. -Sometidos los líquidos a la influencia de la presión del aire, compréndese que no pueden fácilmente convertirse en vapor a causa de la resistencia de la atmósfera, pero si esa presión desaparece, como sucede en el vacío, su producción es instantánea. Para demostrarlo se toman varios barómetros; (fig. 144) y dejando uno A para barómetro tipo, se hace llegar por medio de una pipeta unas gotas de éter, de alcohol y de agua respectivamente, a los tubos B, D, E, y se verá que inmediatamente desciende el mercurio en cada uno de ellos en una cantidad proporcional a la tensión que tome el vapor del líquido correspondiente: lo cual prueba que tan pronto como el liquido llegó a la cámara barométrica, se convirtió instantáneamente en vapor, no pudiendo atribuirse el descenso del mercurio al peso del líquido en el vacío de Torricelli, pues el peso del mercurio comprimido es muchísimo mayor que el del líquido allí colocado. Además se observa que la depresión del mercurio que señala la escala C no es la misma en los tubos barométricos, lo cual prueba que la tensión que adquieren los respectivos vapores no es la misma, siendo mayor en el que contiene el éter y sucesivamente en el alcohol y en el agua. De esta experiencia se deducen las dos leyes siguientes: 1.ª Todos los líquidos se convierten en vapor instantáneamente en el vacío. 2.ª La tensión, o fuerza elástica de los vapores de líquidos diferentes no es la misma en igualdad de temperatura.
267. Espacio saturado. -Si se hace llegar al vacío de un tubo barométrico una corta cantidad de un líquido volátil, éter por ejemplo, se convertirá en vapor y deprimirá la columna de mercurio; si se añade más éter, la depresión del mercurio se hace mayor y si continuamos haciendo llegar éter a la cámara barométrica, llega un momento en que el mercurio no se deprime más y el líquido cesa de convertirse en vapor: entonces se dice que el espacio está saturado (del latín satis bastante) Dos particularidades se observan en este fenómeno, 1.º que un espacio saturado de un vapor ya no admite más vapor y el exceso se liquida; pero sí admite más vapor de otro líquido, también hasta la saturación: así un espacio saturado de vapor de éter, admite vapor de alcohol hasta la saturación y saturado de estos dos vapores, puede colocarse en él otro vapor distinto y 2.º que la tensión del vapor que satura, el espacio tiene un límite para una misma temperatura, sea cual fuere la presión, puesto que la depresión del mercurio cesa desde el momento en que el espacio está saturado. Para demostrar todos estos hechos se hace uso del barómetro de cubeta profunda, de que ya hemos hablado (fig. 97). Haciendo llegar al vacío del barómetro una cantidad, en exceso, de éter de modo que sature el espacio y quede una porción líquida; ya se introduzca el tubo en la cubeta de modo que la presión aumente, ya se eleve y aquella disminuya la altura de la columna de mercurio permanece como antes observándose además que la cantidad de éter líquido es mayor, cuando el espacio se reduce y disminuye, convirtiéndose casi todo en vapor, cuando el espacio aumenta. De lo dicho se deduce, que un vapor saturado, en igualdad de temperatura, no se comprime ni dilata y su densidad por tanto y su fuerza elástica son constantes. Pero si los vapores no están saturados entonces aumenta su tensión cuando el volumen disminuye y viceversa lo cual puede confirmarse con el mismo aparato anterior, pues si se hace llegar a la cámara barométrica una corta cantidad de éter de modo que no sature el espacio, si se sumerge más en la cubeta, el mercurio se deprime en el tubo, lo cual prueba que con la presión aumentó la tensión del vapor; y si el tubo se eleva el nivel del mercurio asciende, porque la fuerza elástica del vapor ha disminuido; observándose en resumen que el volumen del vapor, está en razón inversa de la presión; ley de Mariotte que se cumple lo mismo en los vapores no saturados que en los gases: tal es la semejanza entre unos y otros fluidos. Sin embargo la máxima tensión que puede adquirir un vapor no saturado tiene un límite pasado el cual, y cuando la presión aumenta, el vapor llega a la saturación.
268. Tensión del vapor de agua a diferentes temperaturas. -Son tantas y tan importantes las aplicaciones del agua en sus diferentes estados y muy principalmente en el de vapor, que esta materia fue objeto en todos tiempos de estudio predilecto por parte de la Física y otras ciencias, determinando cuidadosamente cuanto se refiere a los caracteres de este cuerpo. Así ha sucedido con el agua en vapor, cuya tensión ha sido calculada en todas las temperaturas.
A. Tensión del vapor de agua en temperaturas inferiores a 0.º
Para medir esa tensión Gay-Lussac se valió de dos barómetros (fig. 145) uno de los cuales sirve de tipo y el otro tiene su cámara barométrica encorvada de modo que pueda introducirse en hielo o en una mezcla frigorífica. Si se hace pasar a este barómetro unas gotas de agua, tan pronto como este líquido llega al vacío de Torricelli se evapora y con su fuerza elástica ejerce presión sobre el mercurio que se deprime en proporción a la temperatura, del modo siguiente:
| TEMPERATURA | DEPRESIÓN |
| 0º 4mm | 60 |
| -10º 1mm | 96 |
| -20º 0'mm | 84 |
| -30º 0'mm | 86 |
B. Tensión del vapor de agua entre 0º y 100. -Dalton, entre otros varios físicos, determinó estas tensiones valiéndose del aparato (fig. 146) formado por dos tubos barométricos A y B colocados sobre una cápsula de hierro con mercurio, puesta sobre un hornillo y cubierto con un cilindro de cristal, lleno de agua: un termómetro señala la temperatura y una escala lo que el mercurio del barómetro A se deprime. Se hace llegar a la cámara del barómetro A unas gotas de agua que convertida en vapor deprime el mercurio; calentando el agua del cilindro de cristal, el vapor contenido en el vacío de Torricelli va adquiriendo cada vez más tensión y el mercurio desciende hasta que en el momento en que el agua rompe a hervir, es decir cuando tiene la temperatura de 100.º todo el mercurio del barómetro desciende a la cubeta, lo cual prueba que a la temperatura de 100.º el vapor de agua tiene una tensión igual a una atmósfera.
C. Tensión del vapor de agua en temperaturas superiores a 100.º Regnault ha conseguido por medio de un aparato a propósito, y evitando todas las causas de error que pueden ocurrir, hallar la tensión del vapor de agua en temperaturas superiores a 100.º Aparato, operaciones y fórmulas algo complicadas. Con los resultados de éstas y de las anteriores experiencias, se han formado tablas de las diferentes tensiones del vapor de agua, como puede verse a continuación.
Tensiones del vapor de agua entre -30 y 236.º según Regnault.
| TEMPERATURAS | Tensiones en mm | TEMPERATURAS | Tensiones en atmósferas |
| -30º | 0'386 | 100º | 1 |
| 25 | 0'605 | 112'2 | 1'5 |
| 15 | 1'400 | 121'4 | 2 |
| 5 | 3'113 | 128'8 | 2'5 |
| 0 | 4'600 | 131'1 | 3 |
| +10 | 9'165 | 140'6 | 3'5 |
| 20 | 17'391 | 145'4 | 4 |
| 30 | 30'600 | 153'1 | 5 |
| 40 | 53'021 | 160'2 | 6 |
| 50 | 91'982 | 166'5 | 7 |
| 60 | 148'791 | 172'1 | 8 |
| 70 | 233'488 | 177'1 | 9 |
| 80 | 354'650 | 181'6 | 10 |
| 90 | 525'450 | 214'7 | 20 |
| 236'2 | 30 |
Como se ve no hay relación entre la fuerza elástica del vapor de agua y la temperatura; a lo menos aumenta esa tensión en una proporción más rápida que el calor, cuya ley se desconoce hasta el día.
269. Tensión del vapor en espacios desigualmente calientes. -La tensión del vapor en espacios de diferente temperatura es la misma, pero corresponde a la temperatura menor. Sean en efecto dos vasijas (fig. 147) unidas entre sí por medio de un tubo; la vasija A contiene agua a cero grados para lo cual está, rodeada de hielo fundente y la otra B tiene agua que se calienta hasta 100.º y lleva una llave de comunicación. Si los espacios de las dos vasijas no comunican entre sí, en la primera, la tensión del vapor será igual a 4mm'6 y en la segunda a 760mm, pero si se abre la llave y el vapor de la vasija B pasa a A adquiere la tensión correspondiente a la temperatura de éste, o sea de 4mm'6.
LECCIÓN 44. Mezclas de los gases y vapores. -Densidad de los vapores. -Evaporación. -Causas que influyen en la evaporación. -Fenómeno producido en la evaporación.
270. Mezclas de los gases y vapores. Hasta ahora hemos supuesto que la producción de los vapores y la tensión que adquieren, se originaba en el vacío, mas los mismos fenómenos suceden en espacios llenos de aire o de otro gas; observándose además la facilidad con que los vapores se difunden en los gases, tanto mayor, cuanto menor es la densidad de estos últimos. Así, si en dos campanas que contengan respectivamente aire e hidrógeno, se coloca éter sulfúrico, se verá que los vapores de éste tienen la misma tensión en ambas vasijas, pero que en la que contiene hidrógeno que es 14'5 veces más ligero que el aire adquiere el éter el máximum de tensión en la mitad de tiempo que en la que tiene aire. Esta difusión en nada contradice las dos leyes respecto la mezcla de los gases y vapores llamadas leyes de Dalton, que se enuncian:
1.ª La tensión y por consiguiente la cantidad de vapor que satura un espacio dado es la misma ya el espacio esté lleno, ya vacío, si la temperatura es igual en uno y otro caso.
2.ª La fuerza elástica de la mezcla es igual a la suma de las fuerzas elásticas del gas y del vapor mezclados, pero reducido el gas a su volumen primitivo.
Demuéstranse estas leyes por medio del aparato (fig. 148) debido o Gay-Lussac. Un tubo de vidrio T se halla en comunicación por medio de una llave de hierro, cuerpo a quien no ataca el mercurio, con otro tubo de menor diámetro T' y entre los dos una escala dividida en milímetros: el tubo de mayor diámetro lleva en la parte superior una llave D en una guarnición de hierro en la cual puede atornillarse primero un embudo y luego un globo de vidrio; en la parte inferior tiene otra llave. Viértese por el embudo mercurio hasta llenar el tubo T que tomará la misma altura en el otro y se atornilla en seguida el globo de vidrio lleno de aire o de otro gas y abriendo la llave inferior se derramará parte del mercurio dejando en la porción superior del tubo un vacío y abierta la llave del globo parte del aire de éste pasará a ocupar el espacio del tubo T, en el cual el mercurio estará más alto que en el tubo estrecho, lo cual prueba que la tensión es allí menor que la de una atmósfera; viértese entonces mercurio por el tubo T hasta que se restablezca el nivel en ambas ramas. Se quita el globo y se sustituye por la llave R que lleva una cavidad en la que se colocan unas gotas de un líquido volátil; dando vuelta a la llave se vierte el líquido que inmediatamente se evapora, adquiriendo la tensión máxima con lo cual el mercurio desciende en el tubo T y se eleva en el T'; la diferencia de nivel en milímetros indica la tensión del vapor mezclado con el aire. Si ahora se hace llegar al vacío de un barómetro la misma cantidad del líquido volátil, también se evaporará y ejercerá una tensión igual a la que produce en el aparato descrito, siempre que la temperatura sea la misma o será proporcional a la temperatura en el momento de la experiencia. Queda así demostrada la primera ley y la segunda como corolario de la primera.
271. Densidad de los vapores. -Lo mismo que en todos los casos en que nos hemos ocupado de la densidad de los cuerpos, se llama densidad de un vapor, la razón entre el peso de un volumen dado de vapor y el de otro volumen igual de aire puro y seco, ambos en igual temperatura y tensión. Varios métodos se han propuesto para este objeto; el debido a Gay-Lussac se reduce a colocar sobre un hornillo (fig. 149) una cápsula de hierro con mercurio, sobre la cual se halla una campana graduada en litros y fracciones de litro llena también de mercurio, la que se cubre con un cilindro de vidrio lleno de agua que se calienta y cuya temperatura se aprecia por un termómetro T. Se empieza por pesar una ampollita de vidrio; y llena del líquido de cuyo vapor se va a hallar la densidad, se vuelve a pesar, y la diferencia dará el peso del líquido. Introducida la ampollita en el mercurio de la campana graduada y calentando el agua que la rodea, llega un momento en que la tensión del vapor rompe la ampollita de cristal y hace descender el mercurio de la campana; obsérvase entonces la temperatura y el volumen del vapor que indique la graduación de la campana, cuya presión será igual a la que señale un barómetro en el momento de la experiencia, menos la del mercurio que queda en la campana; y con estos datos y hallado el peso de un volumen de aire igual al del vapor, se determina por medio del cálculo la densidad de éste. Este aparato y procedimiento sólo sirve para líquidos que producen vapores a temperaturas hasta 100.º, pero para aquellos líquidos que exigen más calor para evaporarse, se emplea otro procedimiento algo más complicado.
272. Evaporación. -La evaporación o sea la producción lenta de vapor en la superficie de un líquido puede verificarse en todas temperaturas. Así el agua se evapora a cero grados y aún a temperaturas más bajas, en estado de hielo y el mercurio produce vapores a la temperatura ordinaria; pues si en la boca de un frasco que contenga hasta la mitad este líquido metálico, se coloca una hoja de pan de oro, llega a ponerse blanca a causa de los vapores mercuriales. El gran descenso que se observa en las aguas de los lagos, arroyos y ríos, algunos de los cuales llegan a secarse, es debido a la evaporación lenta, cuyos vapores pasan a la atmósfera y la impregnan o se condensan formando las nubes.
273. Causas que influyen en la evaporación. -Cuatro son las causas que principalmente influyen en la evaporación espontánea de los líquidos. 1.ª La temperatura que aumentando la tensión de los vapores acelera la evaporación. 2.ª La cantidad de vapor del mismo líquido que ya tenga la atmósfera ambiente pues, si la atmósfera está saturada de vapor, ya no admitirá más cantidad y la evaporación cesa, (267) al paso que si no existe nada de vapor, la evaporación llegará a su máximum; entre estos dos extremos, la evaporación varía en proporción de la cantidad de vapor existente en la atmósfera. 3.ª La renovación del aire; si éste permanece tranquilo sobre la superficie del líquido, la saturación llega pronto, pero si hay corrientes de aire, no llegará la atmósfera a saturarse y la evaporación se acelera y 4.ª La extensión de la superficie del líquido, porque teniendo lugar la evaporación en la superficie en contacto del aire, cuanto más grande sea ésta, mayor número de moléculas se evaporarán: esto se demuestra colocando la misma cantidad de un líquido, agua por ejemplo, en dos vasijas, una alta y estrecha y otra ancha y de poca altura, notándose que se evapora mucho más pronto en ésta que en la primera.
274. Fenómeno producido por la evaporación. -Los vapores en que se convierte un líquido, absorben una gran cantidad de calor que hacen latente y como en la evaporación lenta no hay foco directo de calor que pueda proporcionarlo, el vapor lo toma de la misma masa líquida, la cual, como es natural, cediendo calor se enfría. El fenómeno, pues, producido en la evaporación es el enfriamiento, por la conversión del calor libre o sensible en latente. Varias experiencias lo confirman: si se vierte éter sulfúrico en la mano, se experimenta un frío bastante notable: si se recubre con algodón el depósito de un termómetro y se vierte sobre el éter, se ve al mercurio descender varios grados bajo cero, sobre todo si se agita un poco en el aire para que haya renovación; y si la evaporación es muy rápida y el líquido produce vapores a bajas temperaturas, puede llegar a solidificarse el mercurio. Si en la experiencia anterior se vierte sobre el algodón ácido sulfuroso líquido que se evapora a -10.º y se coloca el termómetro debajo de la campana de la máquina neumática y se hace el vacío, la evaporación se acelera tanto y es tan grande la cantidad de calor que se trasforma en latente, absorbido por el ácido sulfuroso, que el mercurio se solidifica.
275. Aplicaciones. -El agua que se conserva en las alcarrazas, se mantiene muy fría a causa de que siendo el barro que las forma muy poroso, el agua sale en una corta cantidad a la superficie, se evapora y tomando calor de la vasija y de la misma agua, se enfrían, tanto más, cuanto más se renueva la capa de líquido que baña el exterior. Al evaporarse el agua que tiene en disolución ciertas sustancias, éstas se depositan, pudiendo cristalizar.
LECCIÓN 45. -Ebullición. -Sus leyes. -Causas que influyen en el punto de ebullición. -Calor latente de los vapores.
276. Ebullición. Sus leyes. -Ya hemos dicho ebullición es el fenómeno que acompaña a la producción rápida de vapor por la acción de un foco directo de calor; y está caracterizada por un ruido y un movimiento más o menos tumultuoso en la masa del líquido, que entonces se dice que hierve. En efecto, las burbujas de vapor que se producen en la parte inferior del líquido, siendo menos densas que éste, ascienden y al principio al llegar a las capas superiores de menor temperatura se condensan; pero cuando ya toda la masa ha adquirido una elevada temperatura, esas burbujas se rompen en la superficie del líquido y pasan a la atmósfera: ese movimiento ascensional de las burbujas de vapor producen una serie de vibraciones en el líquido y en la vasija que le contiene, dando origen al ruido característico en la ebullición. Los líquidos necesitan también un grado de calor determinado para hervir que se llama punto de ebullición. La ebullición se halla sometida a las tres leyes siguientes:
1.ª La temperatura de ebullición aumenta con la presión.
2.ª Todo líquido entra en ebullición a un grado constante de calor, si las condiciones de presión y contacto con otros cuerpos son las mismas.
3.ª Sea cual fuere el foco de calor, la temperatura del líquido permanece estacionaria desde el momento que principia la ebullición.
TEMPERATURA DE EBULLICIÓN DE VARIOS CUERPOS A LA PRESIÓN DE UNA ATMÓSFERA.
| Ácido sulfuroso | -10º |
| Ácido sulfúrico anhidro | 30 |
| Éter sulfúrico | 35'5 |
| Sulfuro de carbono | 48 |
| Alcohol | 79 |
| Bencina | 80 |
| Agua pura | 100 |
| Esencia de trementina | 157 |
| Mercurio | 350 |
| Azufre | 440 |
| Zinc | 1040 |
Hirviendo el agua a la temperatura de 100º y teniendo su vapor, a ese calor una tensión de 760mm o sea de una atmósfera (268. C), se deduce que sólo cuando el vapor adquiera esa tensión, entrará en ebullición; ley que es general para todos los líquidos y que se enuncia, ningún líquido entra en ebullición hasta que la tensión de su vapor es igual a la presión que sufre.
276. (bis) Causas que influyen en el punto de ebullición. -Aun cuando según la 2.ª ley de la ebullición, ésta tiene lugar a un grado de calor constante para cada líquido, hay causas que pueden acelerar o retardar ese punto. Esas causas son:
A. Las sustancias que el líquido tenga en disolución. -Si la sustancia disuelta no es volátil o lo es menos que el líquido, retarda el punto de ebullición: así el agua que cuando es pura hierve a 100º, entra en ebullición a temperaturas más elevadas cuando está saturada de diferentes sales:
- Con sal común a 109.º
- Con nitrato potásico a 116.º
- Con carbonato potásico a 135º
- Con cloruro cálcico a 170º
La explicación del fenómeno la creemos fácil: obsérvase que el punto de ebullición se retrasa tanto más, cuanta, mayor es la afinidad entre el sólido y el líquido, como sucede al cloruro cálcico, que es muy ávido de agua y la absorbe fácilmente con sólo estar en contacto del aire húmedo; consecuencia de esta gran afinidad el sólido retiene al líquido con más o menos energía, necesitándose un trabajo médico o una fuerza repulsiva de calor, para que el líquido abandone al sólido y se convierta en vapor, mayor que la que necesitaría el líquido si estuviera puro.
Las materias en suspensión en el líquido, no influyen en su punto de ebullición.
B. La naturaleza de la vasija. -Un líquido colocado en una vasija de vidrio necesita una temperatura más alta para hervir que en una de metal; y si la vasija de vidrio ha sido previamente limpiada con ácido sulfúrico o con potasa, de modo que entonces el contacto entre el líquido y la vasija sea mayor, la temperatura de ebullición aumenta: en esas condiciones, el agua por ejemplo, no hierve hasta 106.º En este caso y en el anterior sea cual fuere la, temperatura a que hierva el líquido, la del vapor es siempre la que corresponde al punto de ebullición del líquido a la presión de una atmósfera.
C. La falta de aire o de otro gas en el seno del líquido y en la superficie. -Dejamos dicho que el agua puede retardar su punto de ebullición si está privada de aire: pues del mismo modo la falta de gas en el interior del líquido o en la superficie, aumenta el punto de ebullición.
Varios físicos observaron este fenómeno, pero quien le estudió detalladamente fue Donny, de Gante, en 1846, valiéndose de un sencillo aparato, (fig. 150) formado por un tubo de vidrio encorvado en los puntos A y B y terminado en D en un ensanchamiento grande y otro más pequeño en el extremo: lavado el tubo interiormente con sustancias que le priven de cualquiera materia que pudiera estar adherida a paredes, se coloca agua en el interior, se la hace hervir hasta que haya seguridad de haber sido expulsado todo el aire del líquido y del tubo; se cierra entonces la punta y no quedará en el tubo más que agua en la parte encorvada y vapor con débil tensión en el resto. Si en este estado se introduce la parte del tubo que contiene agua en un baño de cloruro cálcico y se calienta, puede llegar a tomar la temperatura de 130º sin que entre en ebullición, verificándose esta rápidamente a los 138º. La influencia de la falta del aire en contacto con la superficie del líquido aún se patentiza más, como lo ha hecho Dufour, poniendo los líquidos en suspensión en otros de igual densidad, pero cuyo grado de ebullición sea más elevado, hallándose así privados del contacto del aire De ese modo colocó agua en suspensión en una mezcla de esencia de clavo y aceite de linaza y calentada, vio que el agua no entraba en ebullición hasta los 120º; y el ácido sulfuroso que hierve a 10º retarda su punto de ebullición hasta 18 sobre cero, si se halla en suspensión en una mezcla de agua y ácido sulfúrico. Por último, Dufour observó también que si en un líquido que se encuentro en las condiciones citadas, con una temperatura superior a mi ebullición, se introduce una varilla de vidrio u otro cuerpo sólido, tan pronto como se pone en contacto con el líquido, entra éste repentinamente en ebullición; cuyo fenómeno explica el citado físico por la capa de aire que estos cuerpos tienen en su superficie, no gozando de esta propiedad después que desaparece esa capa de gas, en inmersiones sucesivas en un líquido.
D. La presión. -La influencia de la presión en el punto de ebullición de los líquidos es muy notable, puesto que ninguno hierve hasta que la tensión de su vapor sea igual a la presión que sufre; según que esta presión aumente o disminuya así se adelanta, o retarda ese punto de ebullición. Que la disminución de la presión acelera el grado de ebullición de los líquidos, se demuestra poniendo agua en un matraz que en su boca llevo un tubo fijo en un corcho (fig. 151) se hace hervir el líquido y cogiendo entonces el matraz con un paño o toalla y tapando con el dedo la abertura del tubo, pronto cesa la ebullición; si ahora se introduce en un baño de agua fría, rompe de nuevo el líquido a hervir. La razón de este fenómeno es muy sencilla; tan pronto como se coloca el matraz en el agua fría, el vapor contenido se condensa y deja casi un vacío, entonces el agua, falta de presión, entra en ebullición. También se demuestra esa influencia por medio del hervidero de Francklin (fig. 152) que es un tubo de vidrio encorvado que termina en una esfera a y un depósito b; la esfera y parte del tubo contienen alcohol o éter teñido de rojo y el resto está vacío, o sólo hay en él algunos vapores de éter por haber hecho hervir el líquido en el momento de cerrar el tubo. Si se coge la esfera con la mano, hasta el calor de ésta para que se produzca la ebullición. Modificado el aparato formándole por un tubo recto terminado en dos esferas y con líquido como en el caso anterior, (fig. 153) cogiendo una de las esferas con la mano, se nota un movimiento uniforme en el líquido, por efecto de cada pulsación, lo que ha valido al aparato el nombre de pulsímetro.
277. Hipsómetro. -Disminuyendo la presión del aire con la altura, y ejerciendo esa presión una notable influencia sobre el punto de ebullición de los líquidos, se ha podido hacer una aplicación importante del termómetro para medir la diferencia de altura entre dos lugares, observando el grado de calor a que el agua entra en ebullición. El aparato que se emplea para este objeto se llama ipsómetro (del griego ipsos ebullición y metron medida) y está formado (fig. 154) por un tubo termométrico D, graduado desde 85 a 100 y dividido cada grado en 10 partes iguales: este termómetro está suspendido en el interior de un estuche metálico, el cual lleva en su parte inferior una calderita de cobre que contiene agua que se hace hervir por medio de una lámpara de espíritu de vino. Haciendo entrar en ebullición el agua al pie de una montaña y después en el punto cuya altura se desea conocer, de las temperaturas que señale el termómetro en las dos ebulliciones, se deduce la altura, teniendo en cuenta que la experiencia ha encontrado que por cada grado que descienda el punto de ebullición del agua, corresponden 300 metros de altura.
278. Marmita de Papin. -Con este aparato se demuestra que el punto de ebullición de un líquido puede retrasarse considerablemente a medida que aumente la presión. Consta esta máquina inventada por Dionisio Papin57 de una vasija de cobre estañado interiormente (fig. 155), de paredes muy resistentes con una tapadera del mismo metal que se sujeta muy fuertemente por medio de un tornillo fijo por dos pasadores: en un punto de la tapadera hay un orificio, cerrado por una válvula A sobre la cual se apoya una palanca de segundo género que lleva un peso que puede colocarse a mayor o menor distancia del punto de apoyo aumentando la carga sobre la válvula. Si se desea que el vapor adquiera una fuerza elástica de 4 atmósferas, por ejemplo, se coloca el peso de modo, que cuando llegue esa tensión, venza la resistencia de la válvula, la levante y el vapor se escape; así no hay temor a la rotura del aparato por la fuerza, de tensión del vapor y de ahí el nombre válvula de seguridad con que se conoce esta válvula. Poniendo, pues agua en la marmita hasta los dos tercios y calentándola puede aumentar la temperatura mas allá de 100º sin que el líquido hierva a causa de la fuerte presión a que está sometida la primera porción de vapor producida; pero cuando ésta adquiera una tensión igual a la presión que sufre rompe a hervir, el vapor levanta la válvula y el agua adquiere entonces la temperatura le 100º.
Este aparato ha sido aplicado para la cocción de los alimentos en aquellos puntos en que por hallarse muy elevados, el agua hierve antes de los 100.º no siendo suficiente esta temperatura para reblandecerlos y cocerlos. Así se dice se empleaba en el asilo hospitalario de los monjes del monte de San Bernardo en los Alpes y con esta marmita también, dando una temperatura elevada al agua, sin que hierva, se ha podido extraer la gelatina de los huesos, formándose con ella un caldo muy alimenticio.
279. Calor latente de los vapores. -Como la temperatura de un líquido en ebullición permanece estacionaria (277 3.ª ley) a pesar de hallarse en un foco de calor, este al penetrar en la masa del líquido, se transforma en latente, como acontece en el fenómeno de la fusión: este calor que produce un efecto determinado, como es el de convertir el líquido en vapor y que las moléculas de este se mantengan en el estado de repulsión propio de los cuerpos aeriformes, no obra sobre el termómetro. Este calor se llama latente o de elasticidad o de vaporización.
Ya hemos visto cómo la evaporación lenta en los líquidos produce un enfriamiento mayor o menor, pues del mismo modo una ebullición rápida origina un gran enfriamiento. Varias experiencias lo demuestran Leslie logró congelar el agua, fundándose en este principio. Colocado debajo de la campana de la máquina neumática (fig. 156) un vaso de vidrio que contenga ácido sulfúrico concentrado y encima y a corta distancia una capsulita A de poco fondo con agua; hecho el vacío, entra el agua en ebullición y sus vapores son absorbidos por ácido: si el vacío se mantiene constantemente, la ebullición se hace cada vez más rápida, el agua entonces pierde tanto calor, que los vapores hacen latente, que se enfría hasta el punto de congelarse. Igual prueba puede hacerse con el crioforo (del griego crios frío y foreoo llevar) debido a Wollaston que es un tubo de vidrio encorvado (fig. 157) y terminado en sus extremos por dos esferas; contiene agua que se ha hecho hervir de cerrarlo para expulsar el aire: colocada el agua en la esfera A se introduce la otra en una mezcla frigorífica que condensa los vapores y el agua entra en ebullición, pero tan rápidamente a causa de la condensación sucesiva de los vapores, que el líquido, perdiendo calor, se enfría hasta el extremo de solidificarse.
LECCIÓN 46. Liquefacción de los vapores y los gases. -Estado esferoidal.
280. Liquefacción de los vapores. -Llámase así y también condensación el paso de los vapores y gases al estado líquido. Sin embargo la palabra liquefacción se aplica más principalmente a los vapores. La liquefacción puede efectuarse por el enfriamiento, la compresión y la acción química.
Para que un vapor se condense, o licue por el enfriamiento o por la presión, es necesario que esté saturado; no así cuando interviene la afinidad química, pues muchas sustancias tienen la propiedad de fijar o condensar el vapor de agua sea cual fuere su cantidad. Tan pronto como un vapor se condensa el calor latente o sea la fuerza viva que animó a las moléculas del vapor, se convierte en calor sensible en una cantidad igual; de donde se deduce que al evaporarse un líquido hay pérdida de calor y desarrollo de una fuerza viva y al condensarse o enfriarse, por el contrario, desaparece la fuerza viva y hay producción de calor.
Fundada en la liquefacción de los vapores estriba una operación importante muy usada en Química o sea la destilación que tiene por objeto separar de los líquidos volátiles las sustancias que los impurifican, o dos líquidos cuyo punto de volatilización sea diferente. Los aparatos empleados con este objeto se llaman alambiques o alquitaras. En principio se reduce la operación a evaporar el líquido y condensarle en una parte fría. En Química nos ocuparemos de esta operación.
281. Liquefacción de los gases. -Los mismos procedimientos de enfriamiento y presión y en general los dos reunidos pueden emplearse para la licuación de los gases. Hasta hace poco sólo se había conseguido liquidar ciertos gases, como el cloro, el amoniaco, ácido carbónico, etcétera, y aunque no se había logrado el mismo resultado respecto otros, era creencia que se licuarían y hasta se solidificarían tan pronto como se dispusiese de grandes presiones y los aparatos se prepararan convenientemente. En efecto, ya se han obtenido tan preciosos resultados y hoy se liquida el oxígeno y el hidrógeno con la misma facilidad que el cloro y el amoniaco. Los primeros que licuaron estos últimos gases fueron Davy58 y Faraday59 valiéndose de un sencillo tubo (fig. 15 8) que aún hoy se llama tubo de Faraday. Es un tubo encorvado abierto por un extremo por donde se introduce la sustancia, que por el calor ha de desprender el gas; cerrado después se introduce la rama A que contiene la sustancia en agua que se calienta y la otra B en una mezcla frigorífica; el gas se desprende y ejerciendo sobre sí mismo una fuerte presión, mientras que el frío de la mezcla acerca y condensa las moléculas, el gas se liquida. Para los demás gases se han ideado aparatos especiales, de los que haremos una ligera indicación en Química.
282. Estado esferoidal. -Llámese así el estado que afectan los cuerpos líquidos cuando se hallan colocados en vasijas cuya temperatura es muy superior a su punto de ebullición; los líquidos entonces toman la forma de un esferoide y están animados de un movimiento más o menos rápido. Dedúcese de aquí que un cuerpo líquido puede hallarse en las mayores temperaturas sin que entre en ebullición, no porque adquiera la temperatura de la vasija, sino porque en las condiciones en que se encuentra no llega a adquirir el calor suficiente para hervir. Si se calienta hasta enrojecerla una cápsula de cobre o de platino y se vierte en ella, un poco de agua, inmediatamente toma la forma de un esferoide, moviéndose agitado de un punto a otro dentro de la cápsula. En este estado el líquido se halla en las condiciones siguientes: 1.ª La temperatura del líquido es inferior a la de su grado de ebullición. 2.ª El glóbulo no toca a las paredes de la vasija. Estos hechos y todo lo que se refiere al singular fenómeno del estado esferoidal, han sido estudiados detenidamente por Boutigny. Demuéstrase que el calor del líquido, en estado esferoidal, es inferior al que corresponde a su punto de ebullición, por más que se halle en una vasija de temperatura mucho más elevada, colocando en estado esferoidal una porción líquida, algo considerable de modo qua permita introducir dentro de ella un termómetro de depósito pequeño: si es el agua el líquido esferoidal, el instrumento señalará unos 96'5º y si el ácido sulfuroso -11.º, siendo así que este líquido hierve -10.º Sin embargo el vapor tiene la temperatura de la cápsula. Relacionados con este fenómeno se practican diversos experimentos sumamente curiosos, cual es la congelación del agua dentro de una cápsula o crisol de platino rojo de fuego. Calentada hasta ese punto se vierte en ella ácido sulfuroso líquido, que tomará en el acto el estado esferoidal; si ahora se derrama encima agua en el momento se congela, pudiendo sacar del interior de la cápsula con una pinza de madera, un trozo de hielo. La explicación del fenómeno es fácil el ácido sulfuroso al tomar el estado esferoidal se hallaron una temperatura lo más de -11.º y al ponerse el agua en contacto con él y de su gran frío, necesariamente ha de solidificarse. Que el líquido en estado esferoidal no toca a las paredes de la vasija incandescente, se comprueba con varias experiencias. Si se calienta hasta el rojo una placa de plata A (figura 159) colocada horizontalmente y sobre ella se vierten unas gotas de agua teñida ligeramente de tinta china, tomará el estado esferoidal; cubierto el glóbulo con un cilindro de metal B que tenga dos orificios opuestos y se mira a través de ellos una bujía encendida, se verá la llama por entre la placa y el glóbulo esferoidal, lo cual prueba que éste se halla como suspendido sin tocar a la placa. Si se sustituye ésta por una llena de agujeros en tal número que casi no admita más y se calienta, vertiendo un líquido, adquiere la forma esferoidal moviéndose rápidamente por la superficie de la lámina sin derramarse o pasar a través de los orificios. ¿A causa de que el líquido no toca a las paredes del cuerpo caliente? Porque el líquido en estado esferoidal si bien no hierve, no por eso deja de evaporarse, aunque muy lentamente: envuelto entonces el glóbulo por una atmósfera de vapor, su fuerza elástica obra sobre la placa y el líquido, el cual se ve obligado a elevarse hallándose entre él y la placa una capa de vapor que no permite al calor producir todo su efecto sobre el líquido. Compruébase este hecho vertiendo en una cápsula enrojecida un poco de alcohol u otro líquido combustible que tomará el estado esferoidal; si se aproxima al glóbulo un fósforo o cerilla encendida, se verá arder la atmósfera de vapor que le rodea, permaneciendo en el interior el cuerpo combustible.
LECCIÓN 47. Máquinas de vapor. -Su historia. -División de las máquinas de vapor. -Máquinas de vapor fijas. -Máquina de doble efecto o de Watt.
283. Máquinas de vapor. -Dáse el nombre de máquinas de vapor a todos los aparatos que se mueven por la fuerza elástica o de tensión del vapor de agua. El vapor, producido por la ebullición del agua, obra sobre el émbolo de un cuerpo de bomba a quien pone alternativamente en movimiento rectilíneo, el cual trasformado en circular por varios mecanismos, se trasmite a ruedas y otros aparatos mecánicos.
284. Historia. -Ninguna invención ha producido resultados más positivos en la prosperidad y progreso de las artes y la industria como la máquina de vapor. Elemento poderoso en las oficinas metalúrgicas, auxiliar enérgico en toda clase de fábricas y motor activo en las más rápidas comunicaciones terrestres y marítimas: la gloria del descubrimiento de esta prodigiosa máquina, ha sido disputada por casi todas las naciones. Y no es en verdad nada extraño, pues pocas invenciones han realizado tantas maravillas como esa tenue materia de vapor comprimida convenientemente y que con tanta facilidad se maneja. Por punto general el nombre de esos sabios inventores, de esos ilustres bienhechores de la humanidad, se halla en el mayor olvido o nos es completamente desconocido; y es porque la aplicación práctica de un hecho científico o de un descubrimiento importante no es trabajo de una sola inteligencia. Tal ha sucedido con la máquina de vapor, como con todos los grandes inventos, el telégrafo eléctrico, la fotografía, etc. Escritores diligentes procuran luego averiguar quién ha sido el primero que propuso el medio de lograr este resultado, como sino cupiera tanta gloria y no tuviera tanto mérito el que modifica y perfecciona un invento, haciéndole perfectamente realizable, como el que no hizo más que iniciar el pensamiento o propuso medios imperfectos para conseguirlo.
Algunos hallan los primeros ensayos de la máquina de vapor en experiencias hechas por Heron de Alejandría 120 años antes de J. C.; mas esa clase de trabajos debieron ser de escasa importancia y no vuelven a mencionarse en la historia de la ciencia hasta el siglo XVI, en que un español, Blasco de Garay, hizo la primera prueba de una máquina movida por la tensión del vapor aplicada a la impulsión de los barcos. Hase intentado rebajar el mérito de esta invención y hasta desvirtuarla por completo, suponiendo que el aparato de Blanco de Garay era simplemente una máquina mecánica, sin que para nada interviniera en sus efectos el vapor de agua. No tenemos noticia de que se hayan publicado, si existen, los documentos auténticos en que se apoye esta opinión, que por lo mismo tenemos por infundada, siendo sólo la pasión la que ha podido oscurecer por un momento la gloria alcanzada por el hidalgo de Toledo, cuyo nombre va desde hace tiempo e irá siempre, unido a uno de nuestros buques de la armada, el Blanco de Garay60.
La protección que para sus ensayos pidiera, Garay al Emperador Carlos V, primero de España, no fue dispensada, en el grado que merecía la importancia del invento; así que el espíritu guerrero del monarca y el carácter aventurero de los españoles de aquella época contribuyeron a que la invención de Blanco de Garay quedase olvidada, hasta principios del siglo XVII en que Salomón de Caus61 presentó (año 1614) una máquina en que el vapor de agua producía el efecto, pero sin que diera resultados prácticos, hasta el punto de que aún bastantes años después, el célebre Huygheus, ya citado por haber sido el primero que aplicó el péndulo como regulador de los relojes, no debía tener conocimiento de estos hechos, cuando propuso por, el año 1650, el empleo de los gases de la combustión de la pólvora como fuerza motriz que había de mover un émbolo dentro de un cilindro; de modo que el calor desarrollado en la inflamación de la pólvora enrarecía el aire que se escapaba por una válvula, elevándose el émbolo y dejando debajo de sí un espacio casi vacío en cuya virtud el émbolo descendía por la presión atmosférica. Al finalizar el siglo XVII Dionisio Papin, aceptó desde luego el empleo del vapor de agua y sus trabajos, de escaso éxito en un principio, aplicados a las máquinas de vapor fijas, alcanzaron más tarde en 1707, mejor resultado en la navegación, si bien sus aparatos no reunían todas las condiciones prácticas como los ideados más tarde por Roberto Fulton, el verdadero creador de la investigación por el vapor. Reducíase en principio la máquina de Papin (fig. 160) a un cuerpo de bomba C en cuyo interior podía correr un émbolo elevándose por la tensión del vapor que se producía por la ebullición del agua introducida por a debajo del émbolo y que se calentaba convenientemente. Enfriando en seguida con un chorro de agua fría el exterior del cuerpo de bomba, el vapor se condensaba y el émbolo descendía por la presión atmosférica: estos fenómenos se repetían alternativamente produciendo vapor y condensándole, comunicándose el movimiento del émbolo por medio de una cadena al extremo de una palanca de primer género hallándose en el otro, el cuerpo sobre el cual se producía el efecto mecánico. En esta misma época, es decir, al terminar el siglo XVII, comenzaron en varias naciones los verdaderos trabajos para utilizar el vapor como fuerza motriz, distinguiéndose entre todas Inglaterra, Francia y Alemania y más tarde los Estados Unidos de América. El inglés Eduardo de Sommerset, Marqués de Worcester62, se dedicó también a estudios prácticos sobre la fuerza del vapor, pero sin resultados positivos. Tomás Savery, ingeniero inglés y antes oscuro obrero de minas, logró con su estudio y aplicación alcanzar fama merecida con la instalación en 1698, de una maquina fundada en el principio de la tensión del vapor, para mover las bombas que elevaban el agua, de las minas de carbón de piedra. Poco después Neuwcomen, cerrajero que vivía en Darmouth, distrito de Devoushire, ya entrado el siglo XVIII, perfeccionó la máquina de vapor hasta el punto de aplicarse una muy poderosa, construida bajo los principios físicos y mecánicos de Neuwcomen, para la distribución de las aguas por la ciudad, de Londres y obras para el desagüe de las minas de carbón, principal objetivo a que por entonces se dirigían todos los esfuerzos de los que se dedicaban al perfeccionamiento de la máquina de vapor. La modificación esencial de la máquina de Neuwcomen, consistía (fig. 161) en producir el vapor en una caldera A haciéndole llegar directamente al cuerpo de bomba P, cuyo émbolo elevaba; y condensado después con un chorro de agua fría, que penetraba en el cuerpo de bomba por el tubo, D se originaba un enrarecimiento debajo del émbolo, el cual descendía por la presión de la atmósfera; estos movimientos se trasmitían por el émbolo a diversos mecanismos como el vástago de una bomba aspirante, etc.
Pero todos estos aparatos eran todavía muy imperfectos, demasiado complicados y muy penosos, pues había que abrir alternativamente las llaves del vapor y del agua fría y no se hallaban fundados en las verdaderas relaciones físicas entre la producción del vapor, su condensación y la regularidad de los movimientos que la tensión de esta fuerza había de producir en las diversas partes de la máquina; por cuya razón ofrecían muchos inconvenientes que era necesario hacer desaparecer. Estaba reservada está gloria al ilustre Watt, que modificó esencialmente el aparato de Savery y Neuwcomen, hasta el punto que su máquina, llamada de doble efecto, es la que con ligeras modificaciones se emplea hoy y que vamos a describir. Y fueron tales las alteraciones y los perfeccionamientos que Watt introdujo en la máquina de vapor, la dotó de tales elementos, tan ingeniosamente combinados, que casi puede decirse que fue el verdadero inventor de esta utilísima máquina63.
285. División de las máquinas de vapor. -Estos aparatos se han dividido 1.º Por el modo de obrar el vapor, en máquinas de simple efecto y doble efecto Son máquinas de simple efecto, aquellas en que el vapor obra sobre una sola cara del émbolo, moviéndole en una dirección; y caminando en dirección contraria. después de enfriado el vapor, por la presión del aire, que obra sobre la cara opuesta: tales fueron las primitivas máquinas, que por intervenir en ellas la acción del aire, se llamaron máquinas atmosféricas. En el día todas son de doble efecto, es decir, que en ellas el vapor obra alternativamente sobre una y otra cara del émbolo. 2.º Por la tensión que adquiere el vapor, se dividen en máquinas de baja media y alta presión: son de baja presión aquellas en que la tensión del vapor es muy poco superior a la de una atmósfera; de media presión, si la tensión que alcanza el vapor es de 2 a 4 atmósferas; y de alta presión si pasa de 4 atmósferas. 3.º Por la dirección saque toma el vapor después de haber obrado, en concondención y sin condensación; en las primeras el vapor después de haber producido su efecto sobre el émbolo, se condensa en un depósito de agua fría y en las segundas el vapor después de obrar se pierde en la atmósfera; tal sucede en las locomotora. 4.º Por el modo de funcionar el vapor, en máquinas con expansión y sin expansión; si el vapor obra sobre el émbolo durante todo el trayecto de éste en el cuerpo de bomba, son sin expansión, pero si el vapor sólo penetra en parte en el cuerpo de bomba e impulsa, el émbolo en virtud de su fuerza expansiva, se llama la máquina con expansión y 5.º Según su disposición, en fijas, como las instaladas en las fábricas y talleres y a bordo de los buques; locomóviles las que se mueven sobre ruedas, pudiendo ser trasportadas de un punto a otro y se usan principalmente en las faenas de la agricultura y locomotoras o máquinas de los caminos de hierro.
286. Máquinas fijas. -Máquina de doble efecto. -Esta máquina fija llamada también de Watt, fue la que dispuso este mecánico definitivamente, pues en un principio también construyó sus máquinas de simple efecto. Consta de dos partes muy diferentes, el generador o caldera, donde se produce el vapor y la verdadera máquina.
1.º Generador o caldera. -Los constructores dan a este aparato formas distintas, pero aunque varíen en los detalles, los principios fundamentales son los mismos en todas. Consta (fig. 162) de un gran cilindro de palastro de hierro A B, terminado por dos casquetes esféricos para darle mayor resistencia; debajo hay dos cilindros H, (que en el gravado sólo se ve uno) también de hierro, pero de mucho menor diámetro, que se llaman hervores. Estos cilindros son los que reciben directamente la acción del fuego y están llenos de agua mientras que la caldera lo está como hasta los dos tercios. Encima de la caldera hay diversos orificios que llevan varios aparatos: P un flotador para conocer el nivel de agua en el interior de la caldera; está suspendido de un tirante en el extremo de una palanca de primer género de brazos iguales; el otro extremo lleva un contrapeso: la palanca ha de permanecer siempre casi horizontal, lo cual probará que la caldera tiene bastante agua. T tubo que conduce el vapor a la máquina; T' tubo que conduce el vapor a un manómetro para conocer la tensión; T'' tubo para lanzar el agua a la caldera, M gran agujero perfectamente cerrado, con dos tornillos, por un obturador de hierro y por donde, cuando sea necesario, puede penetrar un hombre para inspeccionar o limpiar la caldera; S silbato de alarma que lleva un flotador unido a una pieza que cierra el pie del silbato y cuando hay poca agua, en la caldera, el flotador desciende y deja escapar el vapor que pasa, rozando contra los bordes de un timbre y produce un sonido: también una llave o palanca movida por la mano puede dar salida al vapor para dar avisos; D válvula de seguridad semejante a la de la marmita de Papin; N tubo comunicante que indica también el nivel del agua.
2.º Máquina.-La fig. 163 representa un modelo de máquina de vapor con cuerpos de bomba de cristal para ver el juego y mecanismo de los émbolos y válvulas y es la que suele hallarse en los gabinetes de Física. La posición del cuerpo de bomba es indiferente y lo mismo puede colocarse vertical que horizontalmente. En la máquina de doble efecto de Watt han introducido diferentes modificaciones los ingenieros y constructores, pero sin que afecten a los principales físicos en que descansa hoy la máquina. Veamos brevemente la disposición de cada una de sus piezas.
a. Caja de distribución del vapor. -Como su nombre lo indica con ella se distribuye el vapor encima y debajo del émbolo. Es una caja (fig. 164) unida al cuerpo de bomba que lleva tres orificios, uno hacia la parte superior, otro en la inferior y otro en el medio; los dos primeros sirven para dar paso al vapor para que obre sobre el émbolo y el tercero comunica con el condensador. Una pieza en forma de D mayúscula, por lo cual se llama válvula en D, tiene una longitud tal, que moviéndose dentro de la caja, si cierra el orificio superior deja descubierto el inferior y viceversa; de modo que el vapor puede obrar alternativamente sobre y debajo del émbolo: si el cuerpo de bomba colocado horizontalmente, el émbolo se moverá de adelante a atrás y al contrario. La válvula en D y el émbolo se mueven alternativamente.
b. Paralelogramo. -Formado por cuatro palancas p p' n n'; en el ángulo de las p y p', se halla articulado el vástago S del émbolo. Tiene por objeto el paralelogramo mantener siempre vertical el vástago del émbolo, pues de lo contrario articulado directamente al extremo de la pieza B se doblaría o rompería y no podría penetrar rectilíneamente en el cuerpo de bomba.
c. Balancín. -Palanca B, de primer género que toma un movimiento de balanza y en cuyos extremos el movimiento rectilíneo del émbolo se convierte en semicircular.
d. Biela. -Barra H, articulada por un extremo al balancín y por el otro a una pequeña palanca o llamada manivela o manubrio, que se halla a su vez articulada al extremo de una barra cilíndrica de hierro denominada árbol de asiento en el cual el movimiento es ya completamente circular.
e. Volante. -Gran rueda V de hierro, que tiene por objeto hacer pasar a la manivela de los puntos muertos, es decir que en virtud de la inercia continúa el volante con la velocidad recibida, mientras que la manivela no debiera girar al hallarse en la parte superior e inferior de su movimiento (puntos muertos) porque en esas dos posiciones tiende a convertirse en rectilíneo.
f. Excéntrica. -Varilla o tirante E, unida por un extremo al árbol de asiento pero fuera del centro de éste, de modo que en el movimiento circular del árbol, la excéntrica camina en sentido horizontal, o con movimiento de vaivén; y por el otro extremo se articula a un sistema de varillas que ponen en movimiento la válvula en D de la caja de distribución.
g. Regulador de Watt. -Como no es posible regularizar la entrada del vapor en la caja de distribución, y por consecuencia en el cuerpo de bomba, el émbolo unas veces se movería con más velocidad y otras con menos e interesa mucho que ese movimiento sea uniforme: Watt lo consiguió por medio del regulador que consiste en un doble péndulo (fig. 165) articulado en un vástago que lleva en la parte inferior una rueda dentada que forma ángulo recto con otra colocada en el árbol de asiento, el cual comunica al péndulo un movimiento de rotación: dos varillas articuladas en r se hallan en comunicación con una palanca s y esta con un tirante de hierro t unido a una pieza circular o válvula que puede cerrar o abrir el orificio de entrada del vapor antes de pasar a la caja de distribución. En la posición natural de los péndulos m n la longitud del tirante es tal, que el orificio está abierto si el vapor penetra en el cuerpo de bomba en gran cantidad o con gran tensión, el movimiento se hace sumamente rápido, los péndulos divergen en virtud de la fuerza centrífuga, tomando por ejemplo la posición m' n', el tirante entonces cierra la abertura y ya no penetra, tanto vapor; la velocidad disminuye, los péndulos descienden y se abre de nuevo la comunicación; de modo que la válvula está continuamente abriendo o cerrando más o menos la entrada del vapor regularizando así el movimiento.
h. Condensador. -Bombas. -En las máquinas fijas se aprovecha el vapor después de haber obrado, que sale por el orificio central de la caja de distribución y pasa al condensador o, donde un chorro de agua fría, lanzado por la bomba D que la toma de un pozo o depósito, le condensa: otra bomba a llamada de aire, extrae del condensador el agua a medida que se llena y la mando a otra bomba G, denominada alimenticia, que la lanza de nuevo a la caldera.
En resumen, el modo de funcionar de la máquina es el siguiente; lleva el vapor de la caldera, penetra por la válvula en D que lo distribuye en el cuerpo de bomba a cuyo émbolo comunica un movimiento rectilíneo que trasmitido al paralelogramo y de este al balancín, se trasforma en circular en la biela y la manivela, que lo trasmiten al árbol de asiento, el cual lleva en un extremo el volante y en el otro una polea por la que pasa una correa sin fin, que pone en movimiento diversos aparatos y útiles mecánicos, como tornos, sierras, máquinas para la fabricación de multitud de objetos etc.
LECCIÓN 48. -Máquinas de vapor para la navegación. -Locomotoras.
287. Máquinas de vapor para la navegación. -Dejamos dicho que después de los ensayos de Blanco de Garay en el puerto de Barcelona, su invención para el movimiento de los buques por medio de la fuerza del vapor, quedó olvidada y no vuelven a aparecer estos trabajos hasta la época de Dionisio Papin, en que este sabio físico instaló en el año de1707 una máquina provista de ruedas en un barco con el cual navegó por el Fulda hasta Munden (Hanobre) y desde cuyo punto pensó atravesar el Weser para dirigirse a Inglaterra. Parece que los barqueros del Weser no solo le impidieron el paso, sino que le destruyeron el buque. Sucesivamente varios físicos y constructores, en Francia, el marqués de Jouffroy, en Escocia Miller y Symington y en América John, Fitch y Runsey hicieron diversas tentativas para establecer la navegación con el vapor; pero todos sus esfuerzos fueron inútiles hasta que en principios del siglo actual Roberto Fulton resolvió satisfactoriamente el problema haciendo con toda felicidad un viaje desde Nueva York a Albany por el río Hudson, a bordo del Clermont, a quien impulsaba una máquina de vapor.64
Las máquinas instaladas en los buques son de las fijas, de doble efecto y alta presión, habiéndose modificado y llevado a un alto grado de perfección hasta en sus más pequeños detalles. De dos maneras se disponen:1.º con el árbol de asiento perpendicular al eje de la quilla, en cuyo caso se llama el buque de ruedas o paletas y 2.º con el árbol paralelo a la quilla, recibiendo entonces el nombre de hélice.
A. Buques de ruedas. -Fueron los primeros que se emplearon. En ellos el árbol de la máquina se prolonga a una y otra banda, saliendo por los costados del buque (fig. 166) y en sus extremos se fijan unas grandes ruedas de paletas. El centro de las ruedas se halla próximamente a flor de agua y por consiguiente la mitad de ellas está dentro del agua y la otra mitad en el aire: entonces girando rápidamente se apoyan en el agua y producen el impulso.
B. Buques de hélice. -La hélice o tornillo no es más que la sección del filete muy ensanchado de un tornillo que se mueve en una tuerca sin fin, que es el agua. Las máquinas de vapor que ponen en movimiento de rotación la hélice, son de un sistema especial en su construcción, pero su fundamento físico es el mismo que el de las demás. El árbol se prolonga hacia la popa del buque (fig. 167) y en su parte inferior se halla la hélice. Esta disposición ofrece grandes ventajas sobre la de ruedas, particularmente en los buques de guerra, pues hallándose el tornillo debajo del agua, no puede servir de blanco a las balas enemigas y además que en casos especiales, como cuando hay necesidad de navegar a la vela y la máquina no funciona y el tornillo está parado, por un mecanismo especial la hélice se puede elevar a bordo y no es un obstáculo para el andar del buque.
288. Locomotoras. -Llámanse locomotoras las máquinas de vapor que colocadas sobre unas ruedas, trasmiten a éstas el movimiento, caminando como un carruaje.
289. Historia. -Dispuesta la máquina de vapor para funcionar con toda regularidad con los inventos y modificaciones de Watt, se pensó aplicarla a la locomoción por los caminos ordinarios. Dícese que un oficial suizo propuso en 1769 la máquina de vapor como elemento de tracción para los carruajes ordinarios. Pero ni esto, ni los ensayos en 1770 de Cugnot, ingeniero francés, ni las tentativas de Olivero Evans, en América, año 1790, tuvieron resultado práctico ninguno hasta que a principio del siglo actual se realizó tan importante adelanto en Inglaterra por dos constructores del condado de Cornuailles, Trivithick y Viviano.
En la imposibilidad de hacer caminar la máquina por los caminos ordinarios, se pensó colocar las ruedas sobre barras, al principio de madera, y poco después, y en la actualidad, de hierro, llamadas rails o barra-carriles. El año 1804 se establecieron las primeras locomotoras, empleándose principalmente para conducir en carros o vagones el carbón de piedra. Varios problemas quedaban aún por resolver; 1.º que las ruedas tuvieran bastante adherencia sobre los rails para que hubiera punto de apoyo para el impulso, lo cual logró el ingeniero inglés Blacket, en 1813, dando un peso proporcionado a la locomotora: y 2.º la disposición de la caldera que no entorpeciese el movimiento de la máquina, lo que se alcanzó con la invención de la caldera tubular. Con estos y otros adelantos se pensó ya en la construcción de grandes vías férreas para el trasporte de mercancías y viajeros. La primera construida en Europa, fue desde Liverpool a Manchester, cuyos trabajos comenzaron el año de 1825, hallándose terminada la vía en 1829. La compañía de esta línea férrea propuso un premio para la locomotora que mejor llenase las condiciones para el arrastre. Tres se presentaron al concurso y la llamada Rochet, del famoso constructor Jorge Setephenson, fue reconocida como la superior, no sólo para el trasporte de mercancías, sino también de viajeros, funcionando con este doble objeto en 1830, en esta línea, con gran regularidad.
Dado el primer paso, toda Europa se apresuró a cubrir sus principales territorios de vías férreas, manifestándose una actividad extraordinaria en la construcción de estas importantes vías de comunicación. Los principios físicos y mecánicos en que se funda la locomotora son los mismos que los de la máquina de vapor fija, pero su disposición es diferente y en ella se hallan suprimidas muchas piezas para que no embaracen el movimiento. En la locomotora hay que considerar también la caldera y la verdadera máquina.
290. Caldera de la locomotora. -Es un gran cilindro de hierro E (fig. 168) cubierto de duelas, generalmente de caoba pintada o de otra materia, para que no se enfríe fácilmente y levante pronto vapor, que ocupa horizontalmente casi toda la máquina en su interior tiene numerosos tubos de cobre que terminan en las bases de este cilindro, estando por el extremo posterior en comunicación con el hogar o caja de fuego, donde se pone el combustible y por el extremo anterior con la base de la chimenea o caja de humos. Los productos de la combustión y las llamas pasan por el interior de los tubos de cobre y hacen hervir el agua que, dentro de la caldera, rodea exteriormente dichos tubos.
291. Máquina. -La forman dos cuerpos de bomba C colocados horizontalmente en la parte anterior a uno y otro lado, exteriormente en unas locomotoras y en obras debajo de la base de la chimenea. El movimiento de los émbolos se trasmite por palancas y manivelas a dos grandes ruedas llamadas motoras; pues las demás que lleva la máquina solo tienen por objeto sostener todo el aparato. El vapor producido en la caldera y acumulado en la cámara B pasa por un tubo que tiene una válvula que abre y cierra el maquinista por medio de una palanca, cuyo vapor después de haber obrado sobre los émbolos se escapa por la abertura central de la caja de distribución por un tubo que va por dentro de la chimenea, a la atmósfera. Es decir que las locomotoras no tienen condensación y por consiguiente no necesitan condensador, ni bomba de agua fría, ni de aire; tampoco llevan volante, porque cuando uno de los émbolos tiene su manivela en un punto muerto, el otro la tiene en el centro. Como la entrada del vapor y su tensión y la velocidad consiguiente en los cuerpos de bomba, la regula el maquinista abriendo mas o menos la válvula, tampoco lleva péndulo regulador: pero sí válvulas de seguridad y manómetro, generalmente metálico. El agua y el combustible van en un carruaje unido a la máquina llamado tender y aquella se inyecta en la caldera por medio de una bomba o un aparato llamado inyector, ingeniosamente dispuesto, de modo que permite lanzar el agua en la caldera a pesar de la tensión del vapor, que necesariamente tiende a salir al mismo tiempo. La locomotora y todo el tren, lo mismo que en los buques de vapor, puede avanzar o retroceder, según que la primera entrada del vapor se verifique por la parte anterior o por la posterior del émbolo, lo cual se logra por un sistema de palancas en comunicación con la caja de distribución y su válvula en D, cuyo extremo puede manejar el maquinista. Como en cada movimiento de ida del émbolo, anda la rueda motora la mitad de su circunferencia; y en el movimiento de vuelta la otra mitad, en el movimiento completo del émbolo avanza la rueda el desarrollo en línea recta de su circunferencia.
LECCIÓN 49. Calorimetría. -Métodos para determinar el calor específico de los cuerpos. -Equivalente mecánico del calor.
292. Calorimetría. -Tiene por objeto la Calorimetría medir la cantidad de calor que absorben o ceden los cuerpos cuando su temperatura aumenta o disminuye un número determinado de grados o cuando cambian de estado. Como no es posible medir la cantidad absoluta de calor que los cuerpos absorben o ceden, se ha tomado por término de comparación el agua; y la cantidad de calor que se necesita para elevar de cero a 1 un kilogramo de agua se llama unidad de calor o caloría y por lo mismo la cantidad de calor que un cuerpo absorbe para pasar de cero a un grado, comparada con la que absorbería, en las mismas condiciones, un peso igual de agua, se denomina calor especifico o capacidad calorífica de un cuerpo. De donde se deduce que no todos los cuerpos tienen el mismo calor específico y es decir, que no todos, en igualdad de peso, necesitan la misma cantidad de calor, para que su temperatura se eleve igual número de grados.
Que no todos los cuerpos tienen el mismo calor específico se demuestra, mezclando un kilogramo de mercurio a 100.º con otro de agua a 0.º y resultarán dos kilogramos con la temperatura de 3.º, es decir, que han desaparecido 97.º de calor que se emplearon en elevar 3.º la temperatura de un kilogramo de agua y por lo mismo se necesitaría una cantidad de calor representada por unos 32.º para elevar un sólo grado el calor del kilogramo de agua, comparado, con que el que en las mismas condiciones absorbería el mercurio. También se demuestra por la experiencia de Tindall: si se hace una torta de cera (fig. 169) y se calientan en un baño de aceite a 180.º diferentes esferas de distintos metales, del mismo peso y se van colocando sobre la cera, se verá que unas la funden primero y la atraviesan (hierro), otras si bien funden la cera, no la atraviesan, (cobre, estaño) y algunos apenas la funden más que una corta cantidad (plomo, bismuto). El hierro, pues, en igualdad de peso y temperatura, contiene más calor que el cobre y este metal más que el estaño.
A. Calor sensible, absorbido por los cuerpos. -Siempre que un cuerpo se calienta de cero a 1 grados, la cantidad de calor que absorbe puede representarse por el producto de multiplicar su peso por el número de grados a que se calienta y por su calor específico, es decir
p t c(a)
Sea en efecto p el peso de un cuerpo en kilogramos, t su temperatura y c su calor específico; como la unidad de medida para los calores específicos es la cantidad necesaria para que pase de cero a 1º un kilogramo de agua, para que alcance esa misma temperatura p kilogramos de agua, se necesitarán p unidades de ese calor; y para hacer pasar p kilogramos de cero a t grados serán precisas t veces más calor o sea pt y por lo tanto para un cuerpo del mismo peso, pero cuyo calor específico sea c, serán necesarias c veces p t o p t c.
293. Métodos para determinar el calor específico. -Tres son las métodos más usados para este objeto, la fusión del hielo, las mezclas y el enfriamiento.
1.º Método de la fusión del hielo. -Este procedimiento está fundado en la absorción del calor latente por el hielo al fundirse, que es igual a 79 unidades por cada kil6aramo, (257). Se logra este resultado por dos medios; empleando el calorímetro de Lavoissier y Laplace o el pozo de hielo de Blak. El calorímetro (fig. 170) está formado por tres vasos de hoja de lata barnizada, concéntricos, dejando entre sí espacios anulares; las cavidades exterior y media, llevan llaves de comunicación A y B, para recoger el agua producto de la fusión del hielo. Todo el aparato va colocado sobre un trípode. Se empieza por poner hielo machacado en los espacios anulares, mientras se calienta el cuerpo cuyo calor específico se va a averiguar; trasladado rápidamente el cuerpo al vaso interior del calorímetro C, se tapa, cubriendo también con una tapadera el vaso exterior, encima de la cual se pone hielo; abriendo la llave del vaso intermedio, se recoge el agua producida por la fusión del hielo mediante el calor que cede el cuerpo. El hielo del espacio más exterior tiene por objeto evitar que el calor del ambiente funda algo del hielo que rodea el vaso interior. Determinado el peso del agua recogida, representará el hielo fundido y como un kilogramo de hielo absorbe, para fundirse, 79 unidades de calor, el peso P del agua recogida, habrá absorbido P veces 79 unidades y como esa cantidad de calor es la que perdió el cuerpo en su enfriamiento, desde la temperatura t que se le dio hasta 0.º es decir p t c (a) se tendrá la igualdad
p t c = 79 P
y

El método del calorímetro ofrece varias causas de error, no siendo la menor el que una parte del agua fundida queda interpuesta entre el hielo y por lo tanto no se recoge toda la que se ha fundido. Evítase éste y otros errores por el método del pozo de hielo. Consiste en un gran trozo de hielo en el cual se practica una cavidad y en ella se coloca el cuerpo con una temperatura determinada, cubriendo la cavidad con otro trozo de hielo. Cuando se calcula que el cuerpo se ha enfriado hasta 0º, se saca, se recoge el agua de fusión del hielo y se pesa.
2.º Método de las mezclas. Este método debido a Black estriba en que dos sustancias con temperaturas diferentes absorben o ceden calor al mezclarse, en razón inversa de su capacidad calorífica. El aparato empleado con este objeto se llama calorímetro de agua y es un vaso cilíndrico de cobre de pareles delgadas y sostenido por hebras de seda para evitar toda pérdida de calor. Se pone en él una cantidad determinada de agua, un kilogramo, por ejemplo, cuya temperatura sea de 12º y en ella se introduce una cantidad dada del cuerpo 0'8 Kg con una temperatura determinada como 100.º Un termómetro muy sensible indica el aumento de calor que adquiere el agua. Si la temperatura de este líquido antes de sumergir el cuerpo era, como hemos dicho, de 12.º y el aumento que toma por el calor del cuerpo es de 4'7, será su temperatura de 16'7º y tendremos que si un kilogramo del cuerpo para enfriarse hasta 1º pierde x unidades de calor o sea su calor específico, los 0 Kg 8 perderán 0 Kg 8 X x; y como el enfriamiento del cuerpo ha sido 100 -12 =88, los 0'8 Kg habrán cedido 0'8 X 8 8 X x. Pues bien, como el calor perdido por el cuerpo ha elevado la temperatura del kilogramo de agua 4'7, o sea desde 12º hasta 16'7, habrá adquirido, dado que su calor específico es la unidad, 1 X 4'7 X 1: el agua, pues ha ganado en calor, cuanto ha perdido el cuerpo y por lo mismo;
0'8 X 88 X x = 1X 4'7 X 1
de donde

3.º Método del enfriamiento. -Fúndase este procedimiento en que, el calor emitido por un cuerpo, al enfriarse, es proporcional al tiempo que tarda en verificarlo. Para determinarlo se colocan el cuerpo cuyo calor específico se desea averiguar y el agua, en volúmenes iguales y a la misma temperatura en dos vasos de igual materia y masa y paredes muy delgadas. Por medio de un termómetro introducido en cada vaso se observa el tiempo que tarda en descender su temperatura un número determinado de grados, 20º por ejemplo. Siendo t el tiempo que tardó en enfriarse el cuerpo, esos 20º p su peso específico y x el calor específico; y t' el tiempo que empleó en enfriarse el agua, p' su peso específico, igual a la unidad y 1 su calor específico, tendremos;
de donde

294. Calor específico de los líquidos y gases. -Los procedimientos que acabamos de indicar para los cuerpos sólidos son aplicables a los líquidos, salvo el que haya acción química entre el líquido y el agua, en cuya caso se emplea el método del enfriamiento. Respecto de los gases puede tomarse como unidad de comparación el agua o el aire, pero teniendo en cuenta la presión y el volumen.
| CALOR ESPECÍFICO DE VARIOS CUERPOS. | |||||
| Sólidos | Líquidos | Gases | |||
| Carbón de leña | 0'24111 | Agua | 1'00000 | Oxígeno | 0'24049 |
| Azufre | 0'20259 | Esencia de trementina | 0'42590 | Hidrógeno | 0'23590 |
| Vidrio de termómetros | 0'19768 | Mercurio | 0'03332 | Nitrógeno | 0'23680 |
| Fósforo | 0'18870 | Cloro | 0'29645 | ||
| Diamante | 0'14687 | ||||
| Hierro | 0'11379 | ||||
| Cobre | 0'09515 | ||||
| Plata | 0'05701 | ||||
| Oro | 0'03244 | ||||
| Platino | 0'03243 | ||||
295. Calor latente de fusión. -Sabemos, lo que se entiende por calor latente de fusión (258) y para determinarlo puede hacerse uso del método de las mezclas, pues al pasar un cuerpo del estado líquido al sólido, desprende una cantidad de calor, igual a la que habrá absorbido durante su fusión. Viértese, pues, una cantidad dada del cuerpo fundido, con el grado de calor correspondiente a su fusión, en agua fría y se ve el aumento de temperatura que adquiere el agua, procediendo en lo demás como dejamos indicado. (291 -2.º)
296. Calor latente de vaporización. -También hemos visto que en el tránsito de un cuerpo líquido al estado de vapor desaparece una gran cantidad de calor que se hace latente. Hase determinado este calor por varios procedimientos, pero que tienen bastantes causas de error y sólo rectificando por medio del cálculo, se puede asignar a cada cuerpo la cantidad de calor de vaporización.
297. Equivalente mecánico del calor. -Hemos indicado ya, siquiera fuera ligeramente, lo que se entiende por equivalente mecánico del calor (232) el trabajo que puede producir la unidad de calor, o el trabajo necesario para hacer pasar desde 0 a 1.º un kilogramo de agua. De modo que el calor puede trasformarse en trabajo y viceversa habiendo, pues, entre el calor y el trabajo una equivalencia. Los físicos modernos que se han dedicado a esta clase de estudios, después de experiencias repetidas y cuidadosamente corregidas las causas de error, tomando el término medio de todos estos ensayos, llegaron a establecer como equivalente mecánico del calor 424 kilográmetros. De modo que la cantidad de calor que hace subir la temperatura de un kilogramo de agua a 1.º, desarrolla una fuerza capaz de elevar un peso de 424 kilogramos a la altura de un metro en 1 segundo de tiempo (34) y recíprocamente un peso de 424 kilogramos que caiga de la altura de un metro en 1 segundo de tiempo, puede desarrollar una temperatura capaz de calentar de 0.º a 1.º un kilogramo de agua.
Importantes consecuencias se desprenden de estos hechos y numerosas son las aplicaciones que de ellos se hacen en el día pero la índole y extensión de estos elementos no nos permiten estudiarlos como lo reclama su importancia.
LECCIÓN 50. Conductibilidad de los cuerpos sólidos, líquidos y gaseosos. -Conductibilidad del hidrógeno. -Aplicaciones.
298 Conductibilidad de los sólidos. -El calor desarrollado en un cuerpo puede, propagarse en su misma masa o a través del espacio: en el primer caso se llama conductibilidad, en el segundo radiación o calor radiante. De, modo que se entiende por conductibilidad del calor, la mayor o menor facilidad con que los cuerpos trasmiten el calor a través de su masa. -Esta propagación se verifica por movimientos vibratorios de molécula en molécula. Como no todos los cuerpos conducen de la misma manera el calor, de aquí la división que se establece de cuerpos buenos y malos conductores. En general los cuerpos sólidos y entre ellos los metales son mejores conductores que los líquidos y estos que los gases. Una excepción hay en el mercurio que aunque cuerpo líquido es buen conductor por su carácter de metal. La densidad de los cuerpos influye notablemente en la conductibilidad del calor, pues en general cuanto más densos y compactos son los cuerpos, mejor conducen el calor; lo cual se explica porque propagándose el calor de molécula en molécula, cuanto más cercanas se encuentren estas con más facilidad se hará la propagación.
Un hecho se ha observado recientemente que viene a confirmar lo que hemos expuesto acerca de la teoría dinámica del calor, y es, que si se coge una barra de acero de 0'm80 de longitud y 15mm de lado, con las manos, pero aplicando una en el medio y la otra en su extremo y el otro extremo de la barra se apoya con fuerza contra una rueda de esmeril que gire rápidamente, se verá que la extremidad frotada se caldea y que la mano colocada en la otra extremidad no puede soportar el calor, mientras que la que coge la barra por el medio, no experimenta apenas efecto alguno de calor. El hecho lo explicamos, porque dada, la buena conductibilidad del acero, la propagación se hace rápidamente produciendo un trabajo mecánico, pero al llegar al extremo término de la barra, no pudiendo propagarse más, el trabajo se trasforma allí en calor.
No todos los cuerpos sólidos propagan de la misma manera el calor y los hay que realmente son malos conductores y aún entre los metales el poder conductriz es diferente. Para apreciar el grado diverso de conductibilidad de los metales, se hace uso del aparato (fig. 171) propuesto por Ingenhousz65 que consiste en una caja de latón con varios orificios cilíndricos donde se atraviesan barras de diversos cuerpos que de antemano se han cubierto de cera en la parte que ha de quedar al exterior; poniendo agua hirviendo en la caja, pronto se ve que la cera empieza a fundirse en unas barras casi en su totalidad y en otras apenas en la parte próxima, a la pared de la caja, lo cual demuestra el distinto poder propagador de cada barra. Despretz66 comparó también el diferente poder conductor de los sólidos por medio del aparato (fig. 172) que se reduce a una barra prismática B, del cuerpo que se quiere ensayar, que de trecho en trecho tiene unas oquedades con mercurio en las cuales se colocan termómetros. Calentada por uno de los extremos, los termómetros señalan temperaturas que decrecen con la distancia al foco; comprobándose de ese modo la ley que dice, que si las distancias al foco de calor crecen en proporción aritmética, las diferencias de temperatura sobre la del aire ambiente disminuyen en proporción geométrica. El orden de conductibilidad de los metales, es oro, platino, plata, cobre, hierro, zinc, estaño, plomo, etc.
299. Aplicaciones. -Son muchas las que ofrecen la buena o mala conductibilidad de los cuerpos sólidos. Todos los objetos y utensilios de metal que han de calentarse mucho y ser cogidos con la mano, es necesario que lleven mangos de madera u otro cuerpo mal conductor, para evitar los efectos del calor. Por la misma razón, la nieve o el hielo se cubren, para trasportarlos, con cuerpos malos conductores, como paja, pues de ese modo, el calor exterior del ambiente no penetra en la nieve y la funde. La rotura que se produce en un vaso de vidrio cuando se vierte en él un líquido muy caliente, es debida a la mala conductibilidad de la materia de la vasija; pues acumulado el calor en un punto, las paredes de aquella se dilatan irregular o desigualmente, pero puede evitarse la rotura introduciendo en la vasija, antes de verter el líquido caliente, un cuerpo buen conductor como la plata, en cuyo caso la mayor parte del calor se dirige de preferencia por el cuerpo de mejor conductibilidad.
300. Conductibilidad de los líquidos. -Hemos dicho que los líquidos, excepto el mercurio, son malos conductores, pero aunque su conductibilidad es bastante débil, no lo es tanto según experiencias de Despretz; pues una corriente de agua a 100º que llegue a la superficie de una vasija de madera de 1'm50 de altura llena de agua y salga en seguida en forma de corriente, sin llegar a mezclarse con el líquido de la vasija, éste se va calentando aunque lentamente, de capa en capa desde la parte superior a la inferior. Este modo de calentarse los líquidos sería sin embargo sumamente lento, por lo cual el foco de calor se coloca en la parte inferior. (fig. 173) Entonces calentándose primero las paredes de la vasija, las moléculas dilatándose se hacen específicamente más ligeras y ascienden por cerca de las paredes siendo reemplazadas por las más densas del centro que permanecen frías, las que al llegar a la parte inferior, se dilatan y ascienden y así sucesivamente, estableciéndose dos corrientes como indican las direcciones de las flechas, hasta que toda la masa se calienta.
301. Aplicaciones. -Cuando se vierte un líquido caliente sobre uno frío no se mezclan, a causa de la mala conductibilidad, permaneciendo el caliente sobre el frío, pero si se los remueve toda la masa adquiere la misma temperatura. Por la misma razón cuando se ponen en contacto en vasos de vidrio, líquidos que tienen entre sí acción química, conviene removerlos para que el calor desprendido en la combinación, se distribuya por toda la vasija, de lo contrario pudiera romperse por ser mala conductora.
302. Conductibilidad de los gases. -No puede fácilmente apreciarse la mala conductibilidad de los gases por medios directos a causa de la gran movilidad de sus moléculas; pero cuando se hallan estos cuerpos contenidos en otros que no les permiten moverse, se nota su escasísima conductibilidad. Así todos los cuerpos muy porosos o entre cuyas mallas tengan gases, son cuerpos malos conductores. Estos cuerpos se calientan por corrientes ascendentes como los líquidos. Una excepción hay entre los gases, que es el hidrógeno que se calienta más fácilmente que los demás a causa de ser mejor conductor: esta conductibilidad del gas hidrógeno es un carácter más de este cuerpo que le hace aparecer como un metal, según opinión de algunos químicos.
303. Aplicaciones. -Las ropas y abrigos de lana y algodón gruesos, que contienen mucho aire entre sus poros, nos sirven como cuerpos malos conductores, para evitar la pérdida de calor del cuerpo. Las dobles puertas y contravidrieras tienen por objeto el que las habitaciones no se enfríen, porque la capa de aire que hay entre vidriera y vidriera, es cuerpo mal conductor.
LECCIÓN 51. Radiación. -Propagación del calor radiante. -Leyes de la radiación. -Equilibrio movible de temperatura. -Reflexión del calor. Sus leyes. -Reflexión aparente del frío. -Poder reflector. -Aplicaciones. -Radiómetro.
-I-
304. Radiación. -Es la propagación del calor al través del espacio: también se llama calor radiante. En la hipótesis de las vibraciones el calor radiante se propaga de unos cuerpos a otros por el movimiento vibratorio que las moléculas de los cuerpos calientes comunican a la materia etérea que se halla en su interior y en el espacio. Así un cuerpo colocado a cierta distancia de un foco de calor, se calienta por que las ondas caloríficas del éter al llegar a la superficie del cuerpo conmueven al éter que hay en su interior el cual, vibrando, como si dijéramos al unisón, adquiere la amplitud y velocidad de las ondas chocantes y presenta la misma temperatura que ellas tienen al comunicar su vibración.
No siempre el calor radiante emitido por un cuerpo es visible y de ahí la diferencia que se admite de calor oscuro como es el del agua a 90º o 100º de temperatura y calor luminoso el que radia el sol o una bala enrojecida.
305. Propagación y velocidad del calor. -Siempre que el calor radiante se mueve en el vacío o atraviesa por un medio homogéneo, la propagación se verifica en línea recta. Esa dirección rectilínea del calor radiante se llama rayo calorífico y en conjunto de varios rayos se denomina haz de rayos. Demuéstrase la trasmisión rectilínea del calor radiante, interponiendo entre un foco de calor y la esfera de. un termómetro, una pantalla con un orificio, de modo que el foco, la abertura de la pantalla y el depósito del termómetro se hallen en línea recta, en cuyo caso la temperatura de éste aumenta, pero sí se baja o sube la pantalla de modo que se intercepte el rayo calorífico el termómetro desciende señalando el calor del aire ambiente.
En la hipótesis de las ondulaciones la línea recula en que se propaga el calor se origina por la unión de los centros de impulso de las ondas; del éter. Respecto a su velocidad, la mayor parte de los autores la comparan a la de la luz, que como veremos, es igual a 54.000 leguas por segundo de tiempo. Pero creemos que debía establecerse claramente la diferencia entre la velocidad de la onda del éter, o sea la rapidez con que vibra y la velocidad de trasmisión. La primera, o sea la conmoción que hace vibrar la onda del calor, es menor que la velocidad con que se conmueve la onda de luz, por más que luego su movimiento por el espacio sea el mismo para unas y otras ondas, que lo dudamos.
306. Leyes de la radiación. -1.ª La radiación se verifica en todas direcciones con la misma intensidad. Varios termómetros colocados a igual distancia en derredor de un cuerpo caliente, acusan la misma temperatura. 2.ª El calor radiante se propaga en el vacío. Por eso los rayos caloríficos del sol llegan a nosotros fácilmente, a pesar de atravesar los espacios planetarios vacíos de toda materia ponderable. 3.ª La intensidad del calor radiante está en razón inversa del cuadrado de la distancia. Demuéstrase esta ley teórica y experimentalmente. Si en el centro de una esfera homogénea y hueca a b (fig. 174) suponemos colocado un foco de calor F, es evidente que cada unidad de superficie del interior de la esfera, recibirá una cantidad igual de calor. Si consideramos otra esfera c c' de doble radio, cada unidad de superficie será cuatro veces mayor, y como el foco de calor le suponemos constante, cada unidad de superficie recibirá ahora cuatro veces menos calor: luego a una distancia doble la intensidad es cuatro veces más pequeña.
Como se ve la intensidad del calor radiante se halla modificada por la distancia al foco; pero también hay otras causas que la modifican, siendo la más importante la inclinación con que los rayos son emitidos, en cuyo caso, la intensidad es tanto menor, cuanto más oblicua es la dirección de los rayos, lo que constituye la ley que dice: la intensidad de un rayo calorífico es proporcional al seno del ángulo formado por este rayo y la normal a la superficie. Por eso el sol calienta menos en el invierno que en el verano, a pesar de su menor distancia a la tierra, porque en la estación de invierno recibe nuestro globo los rayos solares con más oblicuidad.
307. Equilibrio movible de temperatura. -Los fenómenos de la radiación han sido explicados de varia manera. Generalmente se admitía que dos cuerpos de temperatura diferente colocados en un recinto, sólo radiaba calor el de mayor temperatura, hasta que equilibrada ésta en los dos cuerpos frío y caliente, cesaba toda radiación mas Prévost, físico ginebrino, explica el fenómeno diciendo que todos los cuerpos, cualquiera que sea su temperatura, están sin cesar radiando y absorbiendo calor, con la diferencia de que los más calientes radian más que absorben, llegando a bajar su temperatura, y viceversa los más fríos absorben unas que emiten hasta que la temperatura se equilibra en todos; más no por eso cesa la radiación, si no que entonces tanto radian como absorben: este estado ha recibido el nombre de equilibrio movible de temperatura.
El calor radiante cuando llega a los cuerpos puede presentar diversos fenómenos, 1.º ser rechazado o reflejado en la superficie; 2.º penetrar en el interior siendo absorbido, 3.º salir al exterior o ser emitido y 4.º atravesar el cuerpo, cambiando o no de dirección: en el primer caso se dice que se ha refractado, de cuyo fenómeno nos ocuparemos en el estudio de la luz.
-II-
308. Reflexión del calor. Sus leyes. -Los rayos de calor que llegan a la superficie de un cuerpo, si no son absorbidos, sufren un rechazo a la manera de los cuerpos elásticos, es decir, son reflejados, hallándose el fenómeno sujeto a las dos leyes que ya conocemos (105) 1.ª El ángulo de incidencia es igual al de reflexión. 2.ª tanto el ángulo de incidencia como el de reflexión se hallan en el mismo plano, perpendicular, a la superficie reflectante.
Para demostrar estas leyes por lo que toca al calor, se hace uso, bien del aparato de Melloni o de los espejos parabólicos.
1.º Aparato de Melloni. Llamado también termo-multiplicador (fig. 175) consiste en una regla de cobre colocada de canto A B, de un metro de longitud y dividida en milímetros, en la cual se atornillan varias piezas, ya para el estudio de la reflexión, ya también, como veremos, para los demás fenómenos del calor radiante. F es un foco de calor, puede ser un alambre de platino enrojecido por una lámpara de alcohol; P una pantalla para interceptar a voluntad los rayos de calor; P' otra pantalla agujereada para dar paso a los rayos: C es un vástago de metal que sostiene un limbo graduado, en cuyo centro se halla verticalmente el plano de reflexión que suele ser un espejo; en el pie hay una regla R que puede girar y lleva una pila termo-eléctrica. T aparato que estudiaremos más adelante y que ahora solo diremos que si sobre uno de los extremos de la pila cae un rayo de calor inmediatamente desarrolla una corriente eléctrica, cuya intensidad se aprecia para un aparato llamado galvanómetro, que se pone en comunicación con la pila por medio de dos hilos metálicos, por donde pasa la corriente al gasómetro. Por último, una pantalla P'' está colocada entre el foco de calor y la pila, de modo que ésta no reciba más que el calor reflejado.
Un rayo calorífico emitido por el foco, atraviesa la abertura de la pantalla P, incide sobre el espejo y reflejado va a parar a la pila que se halla situada convenientemente, entonces la aguja del galvanómetro señala una máxima desviación quedando luego estacionaria; si se mira en el limbo graduado la posición de una aguja que es normal al plano de reflexión, se notará que es bisectriz del ángulo formado por el rayo incidente y el reflejado; o que dicha normal forma con estos dos rayos, ángulos iguales, que están en el plano horizontal y por consiguiente son perpendiculares a la superficie reflejante.
Sin embargo no todo el calor que incide sobre la superficie es reflejado de la manera que acabamos de indicar; hay una parte del calor que se refleja en otras direcciones y se llama calor difuso o de difusión. Todos los físicos consideran esta reflexión como irregular y así la llaman, con lo cual dan a entender que en este fenómeno el calor no sigue las leyes generales de la reflexión. Nos atrevemos a no admitirla; la reflexión de todos los cuerpos elásticos, llámense marfil, éter de calor, éter de luz, etc. es siempre regular y se verifica constantemente con arreglo a las dos leyes indicadas. Si sucede a veces que no todos los rayos incidentes se reflejan en la misma dirección, es porque no caen sobre el mismo punto o sobre el mismo plano, saliendo con direcciones distintas, según la posición o inclinación de esos planos; pero reflejándose en sus respectivas direcciones, con regularidad, es decir, bajo las leyes enunciadas: por eso en los metales pulimentados o sin asperezas o planos en distintas posiciones, no hay reflexión de calor difuso, al contrario de lo que sucede en los metales sin pulimentar, en el vidrio raspado, etc.
2.º Espejos parabólicos. -Llámanse así y también espejos cóncavos, las superficies curvas, que reflejando los rayos de calor, los concentran en un punto, delante del espejo, que se llama foco. Gozan de esta propiedad en virtud del principio siguiente: si varios rayos de calor inciden sobre la superficie cóncava del espejo, paralelos al eje principal del mismo, después de reflejados saldrán oblicuos encontrándose en el foco y viceversa si los rayos son emitidos oblicuamente desde el foco, reflejados sobre el espejo, saldrán paralelos; mas nada de esto podría suceder, según una de las propiedades geométricas de la parábola, si los ángulos de incidencia y de reflexión no fuesen iguales. La experiencia demuestra que así sucede. Sean los dos espejos parabólicos A y B (fig. 176); si en el foco F de uno de ellos A, se colocan en una rejilla carbones encendidos o una bala enrojecida, los rayos incidirán oblicuamente sobre el espejo y saldrán paralelos yendo a incidir sobre el espejo B y reflejados se encontrarán en el foco F', donde reunidos harán aumentar la temperatura y prueba de que aquí concurren todos los rayos, que si se coloca un cuerpo combustible como fósforo, yesca, etc., inmediatamente se inflama; lo cual no sucede, aunque el cuerpo combustible se aproxime algo más al foco de calor, porque recibirá los rayos aislados y paralelos. Esta propiedad de los espejos cóncavos de reunir en un punto todos los rayos de calor emitidos por un foco y aumentar así notablemente la temperatura, les ha merecido el nombre de ustorios (del latín ustio quemar). La reflexión se verifica en el vacío lo mismo que en el aire.
309. Reflexión aparente del frío. -Si en vez de carbones encendidos se colocan en el foco F del espejo parabólico trozos de hielo y en el foco del otro espejo se pone el depósito de un termómetro, la temperatura de éste desciende bastantes grados. Parece que hay en este fenómeno rayos frigoríficos emitidos por el hielo que enfrían el termómetro; pero esto no es más que aparente, pues el fenómeno. es el mismo que en el caso anterior, con la diferencia de que ahora el foco de calor es el termómetro que radiando calor se enfría.
310. Poder reflector. -Con este nombre se conoce la propiedad que poseen los cuerpos de reflejar cantidades mayores o menores de calor radiante. Para estudiarle fácilmente en los diferentes cuerpos, aún siendo de poco volumen, Leslie dispuso un cubo de hoja de lata que lleva su nombre, lleno de agua a 100º colocado delante de un espejo cóncavo reflector, y entre él y el foco, se pone, apoyada en una varilla, una plaquita u hoja del cuerpo que se va a ensayar. Los rayos emitidos por el foco se reflejan sobre el espejo y desde éste caen sobre la placa que los refleja a su vez hacia un punto donde se halla la esfera de un termómetro diferencial que indica la cantidad de calor reflejado por el cuerpo. De estas experiencias se deduce que el latón amarillo es el de mayor poder reflectante y representado este por 100º, el de diferentes cuerpos es:
| Latón | 100 |
| Plata | 90 |
| Estaño | 80 |
| Acero | 70 |
| Plomo | 60 |
| Tinta de china | 13 |
| Estaño azogado | 10 |
| Vidrio | 10 |
| Vidrio untado con aceite | 5 |
| Negro de humo | 0 |
Varias causas influyen en el poder reflector de los cuerpos: el estado de la superficie, la inclinación de los rayos incidentes, el foco de calor; y el calor según que sea oscuro o luminoso, siendo mayor con el primero que con el segundo.
311. Aplicaciones. -El uso de los espejos ustorios para producir por la reflexión del calor, la inflamación y fusión de los diferentes cuerpos, fue conocido ya por Arquímedes de quien se refiere que en cierta ocasión; incendió con espejos de esta clase, desde Siracusa, los buques romanos que se habían acercado a aquel puerto. A fines del siglo pasado se hicieron experiencias con grandes espejos, fundiendo en su foco, el hierro, el cobre y otras materias. En el día se hace aplicación de esta propiedad, haciendo el revestimiento de las paredes de las chimeneas con mármoles blancos y otras piedras, que reflejan el calor al interior de las habitaciones. Por la misma razón cubrimos nuestro cuerpo en el verano con telas y sombreros blancos para evitar que el calor exterior penetre dentro del cuerpo. Sin embargo Tindall distingue el poder reflector de los cuerpos para el calor oscuro y el luminoso. En este último influye el color; pero respecto al calor oscuro atribuye el poder reflectante, no al color de las telas sino a la clase de tejido y al grado de su conductibilidad.
312. Radiómetro. -Muchos son los fenómenos que produce el calor radiante sobre la superficie de los cuerpos y entre ellos merecen especial mención los estudiados por William Crookes y otros físicos en el radiómetro inventado por el primero más siendo de actualidad estos estudios, no hay todavía acuerdo sobre la explicación de tan curiosos hechos y así nos limitaremos a apuntar una ligera idea acerca de ellos. Consiste en principio el radiómetro, que ha sufrido varias modificaciones, en una cruz de alambres de aluminio en cuyos extremos están soldados unos rombos del mismo metal que llevan ennegrecida una de sus caras dispuestas en el mismo sentido; así se tiene un molinete cuyas aletas son delicadas y de muy poco peso. El centro de la cruz descansa por medio de una pequeña cavidad en una punta afilada de acero y todo él está dentro de un globo de vidrio en el cual se ha hecho el vacío. Si se expone el aparato a la acción del calor radiante emitido por el sol o por otro foco, el molinete gira, alejándose las caras ennegrecidas del foco de calor, con una velocidad que es proporcional, al parecer, a la intensidad de la radiación. Una de las explicaciones de este hecho dice que no siendo posible hacer el vacío perfecto, la cortísima cantidad de aire o de gases que queda en el interior del globo adherido a la superficie muy porosa del negro de humo que cubre una de las caras del aluminio, dilatándose por la acción del calor radiante, ejerce presiones sobre las plaquitas y las hace girar. Sin embargo no está comprobado que la fuerza motriz se origine con regularidad, en cuyo caso el movimiento no sería tampoco regular y no obstante lo es en el radiómetro. Sobre este aparato obra también la luz y la electricidad; pero es verdad que siempre a una y otra acompañan calor; pero aún en el caso que fuera la luz pura o privada de calor, el movimiento que todavía se origina en el radiómetro, pudiera explicarse por la teoría de la trasmutación de los rayos de luz, pues según ella cuando un rayo de luz incide sobre la superficie de un cuerpo opaco, una parte se refleja y otra es absorbida, la cual se trasmuta, disminuida su velocidad, y produce calor de temperatura diferente del radiante. El hielo obra también sobre el radiómetro. Por último, se ha construido un radiómetro diferencial, para hallar la diferencia de iluminación o de calor radiante de dos focos. Es un molinete cuyas aletas terminan en placas de mica, cubiertas por una de sus caras de negro de humo y colocado dentro de un globo de vidrio, cuya mitad de su superficie está también ennegrecida. Si la luz cae perpendicularmente al plano que separa ambos hemisferios, claro y ennegrecido, el aparato no se mueve, pero si ese plano se inclina hacia la izquierda, las paletas de este lado, como más iluminadas, son repelidas y el molinete marcha de derecha a izquierda o viceversa.
Terminaremos citando una particularidad observada en el radiómetro y es que bajo la influencia de las vibraciones de ciertos sonidos musicales, el aparato no es tan sensible a la luz.
LECCIÓN 52. Absorción del calor radiante. -Emisión. -Igualdad de los poderes absorbente y emisivo. -Trasmisión del calor radiante a través de los cuerpos. -Termocrosis.
313. Absorción. -Con este nombre se conoce la propiedad que poseen los cuerpos de dejar penetrar en su masa más o menos calor radiante. El poder absorbente, para un mismo cuerpo, está en razón inversa del poder reflectante, pero sin que por eso, conocido el uno podamos deducir el otro, porque no todo el calor que incide sobre la superficie de un cuerpo es absorbido o reflejado, pues parte de él se convierte en calor difuso.
Leslie se valió de un cubo para determinar el poder reflector, colocando en lugar de la placa del cuerpo, la esfera del termómetro recubierta de pan de oro, de plata, negro de humo etc., observando la temperatura que adquiría el termómetro según el calor que absorbían estas sustancias. De estas experiencias y las hechas por Melloni con su aparato dispuesto para este objeto, se ha deducido que el cuerpo de mayor poder absorbente es el negro de humo igual a 100º y de otros cuerpos el siguiente:
| Negro de humo | 100 |
| Albayalde | 100 |
| Cola de pescado | 91 |
| Tinta de china | 85 |
| Goma laca | 72 |
| Metales | 13 |
El poder absorbente se halla modificado por el foco de calor, pues el albayalde que absorbe 100 rayos cuando el foco que los emite es una placa de cobre calentada a 100º sólo absorbe 24 de una lámpara de Argant. También influyen en la absorción del calor el espesor de la sustancia y la inclinación de los rayos.
314. Aplicaciones. -El gran poder absorbente del negro de humo hace que las vasijas metálicas, como las que forman la batería de cocina, no se les quite la capa exterior de esa materia, pues así se calientan más pronto. Por igual razón nuestros vestidos en el invierno son negros, porque absorben la más pequeña cantidad de calor del ambiente y su poder emisivo de que vamos a hablar es menor. A pesar de esto recordaremos la opinión de Tindall sobre este hecho; que si bien es cierto, su causa no está precisamente en el calor sino en la clase de tejido y en la conductibilidad.
315. Emisión. -Es la radiación del calor; esto es la propiedad que tienen los cuerpos, en igualdad de condiciones, de irradiar o emitir cantidades mayores o menores de calor. La emisión es relativa y se la compara con la que en los mismos casos emite el negro de humo. Varios físicos por diversos procedimientos, han determinado el poder emisivo de los cuerpos, pero sus resultados no son iguales, por lo que toca a los metales: Leslie y Melloni se valieron del cubo de hoja de lata con agua a 100º y cuyas caras estaban cubiertas por diversas sustancias y dirigiéndolas sobre un espejo reflector, como lo hizo Leslie, se anotaba la temperatura que señalaba la esfera del termómetro colocada en el foco del espejo o bien se dirigían sucesivamente las caras del cubo a la pila termo-eléctrica. Los resultados obtenidos por estos físicos y los hallados por Desaius y de la Provostaye, con relación a los metales, son:
| Negro de humo | 100 |
| Albayalde | 100 |
| Cola de pescado | 91 |
| Tinta de China | 85 |
| Goma laca | 72 |
| Platino bruñido | 10'80 |
| Plata mate | 5'36 |
| Cobre | 4'90 |
| Oro | 4'28 |
| Plata bruñida | 2'50 |
También el poder emisivo se halla modificado por varias causas, como el espesor de los cuerpos radiantes sobre todo si estos no son metálicos: el estado físico, pues si los cuerpos están reducidos a polvo, su poder emisivo varía; la temperatura y la inclinación de los rayos en la superficie que los emite.
316. Aplicaciones. -No son tan numerosas como las que se refieren o la facultad reflectante y absorbente. Sin embargo diremos, que por regla general para conservar un cuerpo caliente deberá colocarse en otro cuerpo de poco poder emisivo como la plata o el cobre.
317. Igualdad de los poderes absorbente y emisivo. -Lealie fue el primero que enunció el principio general de que en un mismo cuerpo el poder absorbente y emisivo eran iguales; es decir, que si absorbía una cantidad de calor como cuatro, emitía también la misma cantidad. Experiencias posteriores han confirmado la exactitud de este principio; pero con las condiciones siguientes; que en un mismo cuerpo el poder absorbente es proporcional al emisivo, siempre que la temperatura para uno y otro caso sea la misma, esto es, lo mismo cuando absorbe que cuando emite; y que ambos calores sean de la misma naturaleza, los dos oscuros o los dos luminosos.
318. Trasmisión del calor al través de los cuerpos. -Dejamos dicho que uno de los fenómenos que produce el calor radiante, es atravesar los cuerpos, sin calentarlos, yendo a hacer su efecto térmico más allá de los mismos cuerpos más no todos gozan de esta propiedad y los que la poseen la tienen en grado diferente. Los metales no dejan pasar nada de calor radiante, o es reflejado o absorbido. Melloni a quien se deben muy notables trabajos sobre estos fenómenos, que estudió cuidadosamente, divide los cuerpos con relación o esta propiedad en diatermos (del griego dia al través y termos calor) y atermos (del griego a sin y lermos calor). Los primeros dejan pasar a su través, más o menos fácilmente, el calor radiante y los segundos se oponen a su paso; y respectivamente estas propiedades se llaman diatermancia y atermancia.
319. Aparato de Melloni. -Este aparato, ya citado, se dispone para este caso (fig. 177) con un foco de calor F, que puede variar, ya es un cubo de Leslie; ya una lámpara de Locatelli, con reflector y sin tubo de vidrio, o un espiral de platino enrojecido; una pantalla P, un soporte C donde se colocan los cuerpos en forma de hojas, otras pantallas P' y P'' y la pila termo-eléctrica T con su galvanómetro R. Colocando las diferentes sustancias en el sostén C y
si son líquidos en pequeñas vasijas de vidrio de caras paralelas, distantes entre sí un centímetro, los rayos de calor que las atraviesan caen sobre la pila y la aguja del galvanómetro indica con su desviación la fuerza de la corriente eléctrica, originada por el calor, que es tanto más intenso cuanto mayor es la cantidad del calor que obró sobre la pila y por consecuencia que dejó pasar el cuerpo. Hay muchas causas que influyen en el mayor o menor poder diatermo, tal es el estado de pulimento, el espesor del cuerpo y el número de pantallas que aumentan o disminuyen la diatermancia, pero sobre todas estas causas influye de un modo notable el foco de calor. He aquí los resultados obtenidos según el foco empleado.
| SUSTANCIAS | LÁMPARA de Locatelli | PLATINO incandescente | COBRE a la temperatura de 400º | COBRE a la temperatura de 100º |
| La sal gema deja pasar | 92 | 92 | 92 | 90 |
| El espato de Islandia | 39 | 28 | 6 | 0 |
| El cristal de espejos | 39 | 24 | 6 | 0 |
| Íd. el de roca | 37 | 18 | 6 | 0 |
| La cal sulfutada | 14 | 5 | 3 | 0 |
| El alumbre | 9 | 2 | 0 | 0 |
| El hielo puro | 6 | 0 | 0 | 0 |
De estos hechos se deducen varias consecuencias: 1.ª que en la sal gema, la sustancia más diaterma, no influye el foco de calor, 2.ª que el poder diatermo disminuye con la temperatura; 3.ª que el calor luminoso, como el de la lámpara de Locatelli y el platino enrojecido, es más fácilmente trasmisible que el oscuro. También se deduce que no hay relación entre la diafanidad o sea la propiedad de dejar pasar la luz y la diatermancia, pues el alumbre que trasmite bien la luz, deja atravesar muy poco calor radiante y al contrario, el cristal de roca ahumado que no da paso a la luz, es diáfano para el calor.
320. Diatermancia de los gases. -Hasta los trabajos de Tyndall, se había creído que los gases tenían una diatermancia perfecta; pero el sabio físico inglés ha demostrado que los gases simples dejan pasar casi todo el calor radiante, mientras que los compuestos, como el ácido sulfuroso, el amoniaco, etc., son completamente atermos.
321. Termocrosis. -Melloni en vista de los resultados de todas sus experiencias, admite la existencia de rayos de calor con caracteres distintos o que un rayo se halla formado de otros varios, dotados de propiedades diferentes y de atravesar más o menos las diversas sustancias; llamando termocrosis (del griego termos calor y crosis color) a la facultad que presenta el calor de estar formado por rayos de propiedades distintos y por lo mismo los cuerpos absorben una clase de esos rayos y dejan pasar otros, ni más ni menos que sucede con los rayos coloreados de luz, poseyendo en consecuencia los cuerpos una especie de coloración calorífica; y de aquí la división de los cuerpos en termocróicos que solo trasmiten rayos de ciertos focos de calor y atermocróicos los que dejan pasar toda clase de rayos cualquiera que sea el foco.
322. Aplicaciones. -El aire es diatermo, pues aunque es cuerpo compuesto, no están sus elementos en combinación, sino en mezcla, y deja pasar el calor sin que las capas superiores de la atmósfera se calienten. Por medio de las sustancias diatermas, se puede separar el calor de la luz, como sucede con el alumbre que detiene el calor y deja pasar la luz; al contrario la sal gema ennegrecida que no deja penetrar la luz y permite pasar fácilmente el calor.
LECCIÓN 53. Orígenes del calor. -Manantiales mecánicos. -Ídem físicos. -Íd. químicos. -Calor animal.
323. Orígenes del calor. -En rigor no hay más que un origen o manantial de calor, el movimiento molecular de los cuerpos (231-b): este movimiento puede originarse por diferentes medios, convirtiéndose cada uno de ellos en verdadero manantial de calor; de aquí los manantiales mecánicos, físicos y químicos.
324. Manantiales mecánicos. -Cualquiera acción mecánica que produzca movimiento molecular desarrolla calor; tales son el frotamiento, la presión y la percusión
A. Frotamiento. -Siempre que dos cuerpos se frotan, desarrollan calor, tanto más intenso, cuanto más rápido es el movimiento y más íntimo el contacto de los cuerpos frotados diferentes aparatos y experiencias lo comprueban; entre ellos es curioso el propuesto por Tyndall (fig. 178) que consiste en un tubo de latón A de un decímetro de altura lleno de agua, un poco caliente para abreviar la operación, y cerrado con un tapón para que no se derrame en el movimiento; este tubo está fijo en el centro de una polea y puede girar rápidamente por medio de una correa sin fin B que pasa por la polea y por una rueda. Abrazado el tubo con presión por medio de dos tablas P unidas por un gozne y haciéndole girar, el frotamiento desarrolla una cantidad tal de calor, que el agua se evapora y su fuerza elástica hace saltar el tapón con violencia. El rozamiento influye de tal modo en la producción del calor que en un mismo cuerpo, con igual velocidad, el calor es menor cuando su superficie está pulimentada, que cuando tiene asperezas.
Rumford, al barrenar debajo del agua una masa de bronce, apreció el calor desarrollado por el roce para obtener 250 gramos de limaduras, en 2500 calorías, es decir, que sería capaz de elevar 25 kilogramos de agua desde 0º a 100.º El rozamiento de las ruedas de los carruajes contra el eje produce a veces su inflamación: los instrumentos de acero que se afilan en las piedras destinadas a este objeto, producen fuertes chispas por su roce contra la rueda; y en fin, el rozamiento de esas masas meteóricas, llamadas aerolitos, de que hablaremos en Meteorología, contra el aire atmosférico, produce su incandescencia. En todos estos casos, hay un trabajo mecánico que da por resultado la trasformación del movimiento en calor.
B. Presión. -La presión ejercida en los cuerpos desarrolla calor, proporcional a la compresión que sufren: los gases, que son muy compresibles, desprenden gran cantidad de calor al reducirlos a menor volumen Así se demuestra por medio del eslabón neumático (fig. 179) que es un tubo de vidrio de paredes resistentes en el cual puede deslizarse un émbolo que ajusta exactamente y que lleva en su base una pequeña cavidad donde se coloca un poco de yesca. Al introducir el émbolo dentro del tubo lleno de aire y comprimir éste bruscamente, la yesca se inflama, lo cual supone el desarrollo de una temperatura de 300.º En el acto de la compresión brota también luz, pero este efecto es debido a la porción de aceite con que se unta el émbolo para que resbale más fácilmente. Por lo demás el calor en este caso, es debido no solo al rápido movimiento que toman las moléculas del aire, sino que reducido extraordinariamente su volumen, parte del calor latente se trasforma en libre.
Tyndall, cuyos trabajos sobre el calor revistan tanta importancia, ha hecho curiosas experiencias que demuestran que si el movimiento de las moléculas de un cuerpo se verifica por su propia impulso, en lugar de desarrollarse calor, se produce frío, porque entonces una parte del calor se emplea en producir el movimiento de las moléculas; tal sucede a una masa de aire o de otro gas, fuertemente comprimida en una vasija armada de una llave que en el momento que se abre, sale el aire por su propia fuerza elástica, produciendo un descenso de temperatura, pues en este caso el gas al dilatarse absorbe calor que hace latente. Por el contrario, si la corriente de aire se produce por un trabajo exterior al gas, todo el movimiento se trasforma en calor, como sucede con la corriente que produce un fuelle.
Si el movimiento de un cuerpo se destruye repentinamente, la fuerza viva que producía el movimiento no se aniquila, sino que se trasforma en calor. Las balas disparadas por grandes cañones contra las planchas de hierro destinadas al blindaje de los buques, para probar su resistencia, al detenerse repentinamente, en el choque contra la plancha, se eleva su temperatura hasta el rojo.
C. Percusión. -Si se golpea sobre un yunque un metal maleable aumenta de un modo notable su temperatura. Percutiendo con el eslabón el pedernal saltan chispas del acero inflamado.
325. Manantiales físicos. -A. El Sol. Es el manantial más fecundo de calor. ¿Cuál es la causa del calor y de la luz del Sol? Sólo hipótesis se conocen acerca de este punto, cuya exposición no corresponde a estudios elementales. Sólo diremos que los estudios del sabio P. Sechi67 confirman que el calor emitido por el centro o núcleo del astro, es mucho mayor que el que producen los bordes y menor aún el que se origina cerca de las manchas del Sol o sean partes oscuras, que en las porciones brillantes. La temperatura de los rayos caloríficos del sol ha sido medida, entre otros instrumentos, con los pirheliómetros (del griego pir fuego, helios sol y metron medida.) Con los datos recogidos por estos medios se ha calculado que la cantidad de calor que anualmente manda el sol a la tierra, es por término medio de 231.000 calorías por cada centímetro cuadrado: más no toda esa inmensa cantidad de calor es recibida por nuestro planeta, pues de 100 partes sólo 68 llegan a la tierra, perdiéndose 32 en el espacio o en la atmósfera. Esa cantidad total de calor sería capaz de fundir una capa de hielo de 33 metros de altura que rodeara toda la tierra. Las estrellas y la luna también emiten calor, pero es tan débil el que llega a la tierra, que no merece fijar la atención como foco de calor.
B. La tierra. -Nuestro planeta tiene también su calor propio en el interior, por lo cual se llama calor central. A partir de la superficie de la tierra, la temperatura disminuye hasta una línea o plano, cuya profundidad varía según las latitudes. donde el calor es invariable y se llama línea de temperatura constante y también linea isogeoterma. Desde esa zona, el calor va aumentando un grado por cada 30 ó 40 metros que se profundiza. La temperatura pues del centro de la tierra, dado su radio, debe ser extraordinariamente grande; pues ya a no muy grandes profundidades, es considerable, como lo demuestran las aguas termales y las erupciones volcánicas. Sobre la causa de este calor se han emitido varias opiniones, pero la más generalmente admitida, es la que afirma, que hubo un tiempo en que toda la tierra estuvo fundida; que enfriándose luego por radiación, se solidificó en su superficie, quedando encerrado en el interior un gran núcleo de materia fundida (pirosfera. -Esfera de fuego), causa entre otros fenómenos térmicos de las erupciones volcánicas. No faltan sin embargo físicos y geólogos, que aun admitiendo el origen igneo de la tierra, sostienen que ésta se halla solidificada completamente, y que el calor actual es debido a las reacciones químicas de su interior, y a efectos mecánicos producidos por grandes rozamientos de las rocas y terrenos que descienden lentamente a causa de las inmensas cavidades originadas en el interior por la acción corrosiva de las aguas.
C. Las acciones moleculares. -Entre éstas la absorción de los gases principalmente, es un foco enérgico de calor. El musgo o esponja de platino, o platino sumamente dividido, absorbe o fija tanta cantidad de hidrógeno que llega a ponerse incandescente.
D. La electricidad. -Es el manantial más activo de calor de que el hombre dispone: con ella se funden y volatizan los metales más refractarios al calor. Ya tendremos ocasión de estudiar sus efectos en el libro sétimo de estos Elementos.
326. Manantiales químicos. -Toda combinación química va acompañada de desprendimiento de calor, a veces débil, pero en lo general tanto más intenso cuanto más rápida es la combinación.
Si el calor producido por la combinación llega a convertirse en luz, entonces se produce la combustión cuyo estudio corresponde a la Química.
327. Calor animal. -Todos los animales tienen una temperatura que les es propia y cuyo calor se produce, en su mismo organismo, por causas mecánicas, como el roce en la circulación de la sangre el de los músculos en sus movimientos; por causas químicas como la digestión, la respiración etc. y por causas puramente fisiológicas, como la acción del sistema nervioso. En el hombre esa temperatura es de 36'6º y no varía sea cual fuere el medio ambiente en que viva.