Nociones preliminares
LECCIÓN 1. Química. -Diferencia entre la Física y la Química. Moléculas. -Átomos. -Combinación. Mezcla. -Afinidad. -Causas que la modifican. -Cristalografía. -Isomorfismo. Dimorfismo. Alotropía. Isometría. Análisis y Síntesis.
-I-
1. Química. -Es la Química la ciencia que tiene por objeto el estudio de la constitución íntima de los cuerpos simples, de las combinaciones a que dan origen y las leyes que presiden a éstas. Se divide generalmente en Inorgánica y Orgánica. La Química inorgánica estudia todos los productos de origen inorgánico o mineral y la orgánica, los de origen orgánico animal o vegetal: división no muy natural, y que debiera desaparecer, a lo menos para ciertos productos.
2. Historia. -Los principios y fundamentos de la Química actual, sólo datan de fines del siglo pasado. En tiempos anteriores, esta ciencia, llamada más particularmente alquimia (del árabe al aumentativo y quimia química alta-química) era tan solo un conjunto de hechos aislados, sin enlace filosófico. Los alquimistas daban a sus estudios una gran importancia y procuraban rodear del misterio todos sus trabajos y hasta el lenguaje que empleaban para representar los cuerpos y sus combinaciones era puramente simbólico. Aún así la ciencia moderna debe mucho a la incansable laboriosidad de los alquimistas de la edad media, que, ya fuera debido a la casualidad o a otras causas, descubrieron muchos cuerpos. Por eso los nombres de Raimundo Lulio, Basilio Balentino, Brand y otros, se recuerdan hoy con respeto por los beneficios que prestaron a la ciencia. La idea de hallar una sustancia (piedra filosofal) que pudiera convertir los metales llamados innobles, en metales preciosos, como el oro y la plata, lo cual era un verdadero delirio, no era sólo el objeto exclusivo que se proponían los alquimistas en sus investigaciones.
Pero los grandes adelantos de la Química y el admirable desarrollo que ha alcanzado en breve tiempo, son de época moderna, como veremos al ocuparnos de las Teorías de la Química.
3. Diferencia entre la Física y la Química. -Hemos visto que la Física no estudia en rigor los cuerpos, sino las propiedades generales y los fenómenos que en ellos producen ciertos agentes, como el calor, la luz y la electricidad; la Química por el contrario estudia los cuerpos individualmente procurando, averiguar la constitución o naturaleza de cada uno. La Física al estudiar un fenómeno no se cuida de conocer el cuerpo que le origina; no así la Química que estudia cada cuerpo en todos sus detalles. Ejemplo: el físico al estudiar la caida de los cuerpos o la refracción de la luz, no le interesa conocer la naturaleza del cuerpo que cae o hace cambiar la luz de dirección, ya sea vidrio, cristal de roca, azufre etc.; no así el químico que necesita ante todo conocer la constitución del cuerpo que produce el fenómeno: en fin, casi podríamos decir, que la Física estudia los fenómenos independientemente de los cuerpos y la Química estudia los cuerpos más particularmente que los fenómenos que producen: la Física generaliza en sus estudios, la Química individualiza en sus procedimientos.
4. Moléculas. Átomos. -Hemos visto en visto en Física que los cuerpos son simples y compuestos; que unos y otros están formados por moléculas y átomos, y que estas dos palabras suelen tomarse como sinónimas. La palabra átomo no tiene sin embargo, bien determinada su significación; pues a juzgar por su etimología (del griego a sin, tomos sección o fracción) designa la última porción de la materia que no se puede dividir o fraccionar lo cual más que un hecho físico, es una concepción abstracta, pues si los átomos se penetran para combinarse o unirse químicamente, es evidente que pueden separarse. Las moléculas pueden ser todas homogéneas y se hallan integrantes; o diferentes y heterogéneas y se denominan constituyentes: las primeras son propias de los cuerpos simples y compuestos; las segundas solo de los compuestos. Así las moléculas del hierro, cuerpo simple, son todas de la misma naturaleza o integrantes y también lo son las de la cal o del agua, cuerpos compuestos; pero cada molécula integrante de un cuerpo compuesto está formada por otras diferentes o constituyentes; así la molécula de agua la forman dos constituyentes oxígeno e hidrógeno.
La fuerza atractiva que une y mantiene unidas moléculas integrantes se llama cohesión y, la que determina la unión de las constituyentes se llama afinidad o fuerza de combinación.
5. Combinación. Mezcla. -Se llama combinación la de dos o más cuerpos, en proporciones definidas y en la que desaparecen las propiedades de los componentes. Toda combinación química va acompañada siempre de desprendimiento de electricidad y de calor y a veces de luz. La mezcla es la reunión de varios cuerpos en la que no desaparecen las propiedades particulares de los componentes y no va acompañada de los fenómenos que caracterizan la combinación. Los elementos combinados no pueden separarse por los medios mecánicos, ni por la disolución, ni percibirse con el microscopio; al contrario, en la mezcla, por íntima que sea, que por la disolución o por un medio mecánico se aíslan los cuerpos que la forman, pudiendo distinguirse, si los cuerpos mezclados son sólidos, con el auxilio del microscopio. El agua es una combinación; el aire o la pólvora una mezcla. Si la combínación es de dos cuerpos simples o elementos se llama binaria, si de tres ternaria, si de cuatro cuaternaria, etc.
6. Afinidad. -Dejamos dicho que afinidad es la fuerza que determina la unión de los átomos diferentes que constituyen los cuerpos compuestos En unos cuerpos esta fuerza, especie de simpatía, es muy enérgica y se necesita emplear procedimientos especiales para separar sus elementos: en otros es muy débil y con la mayor facilidad se descomponen en sus elementos constitutivos, cual si existiera en ellos una verdadera antipatía; tal sucede los fulminantes y materias explosivas.
Cuando la afinidad es enérgica, el desarrollo de calor es considerable; tal se observa al poner en contacto un trozo de fósforo y un poco de yodo, que inmediatamente se combinan con gran desprendimiento de calor y luz; o bien dejando caer un pedazo del metal potasio en el agua, que se inflama y arde con llama purpúrea; pues dada su afinidad con el oxígeno, descompone el agua y se combina con aquel elemento.
7. Causas que modifican la afinidad. -Cuando decimos que dos o más cuerpos se combinan, entiéndese que han de hallarse en condiciones especiales, pues hay varias causas modificantes de la afinidad, que en unos casos la favorecen y en otros la perjudican oponiéndose a que los cuerpos se combinen: estas causas son:
1.ª La masa o sea la cantidad de los elementos que van a combinarse. Una sola proporción de ácido nítríco puesta en contacto con el sulfato de barita, no produce acción química ninguna, pero si se ponen tres o más proporciones, la afinidad se desarrolla, el ácido nítrico se combina con la barita y forma nitrato de barita.
2.ª La cohesión. Para que una combinación se verifique es necesario que las moléculas de los componentes, se hallen en el mayor contacto, lo cual no se logra, mientras predomine la cohesión, perjudicando pues esta fuerza a la afinidad, pero si la cohesión desaparece, bien porque el cuerpo se funda o gasifique o bien porque se halle en disolución, la combinación se verifica fácilmente. La influencia del agua como disolvente es muy notable y de aquí el aforismo de los antiguos químicos (alquimistas) que decía corpora non agunt nisi soluta.
3.ª El calor. En general el calor favorece las combinaciones pero en ocasiones las perjudica; el mercurio a los 340º se combina con el oxígeno, pero a una temperatura superior se separan estos dos elementos. El calor obra dilatando las moléculas de modo que puedan fácilmente penetrarse: así los cuerpos fundidos se combinan mejor que en el estado sólido; la mayor parte de las combinaciones se auxilian por el calor, que se emplea en los laboratorios de Química, desde el producido por una simple lámpara de espíritu de vino, hasta el desarrollado en hornos especiales. Los alquimistas que conocían bien la eficacia del calor en la afinidad dijeron, en otro aforismo, sine igne nihil operamur. Pero también en muchos casos el calor se opone a la afinidad o la destruye, descomponiendo los cuerpos; así los llamados nitratos como el salitre, y muchos carbonatos se descomponen por la elevación de temperatura.
4.º La luz. También obra como causa modificante, la luz, favoreciendo o perjudicando la afinidad, primer caso: si se pone en un frasco una mezcla de cloro e hidrógeno en volúmenes iguales y se guarda en la oscuridad, se conserva sin combinarse; pero si se expone a la acción directa de la luz del sol, inmediatamente se combinan con explosión. Segundo caso. El nitrato de plata y otros compuestos y muchas materias colorantes, se alteran o descomponen por acción de la luz, por lo cual hay que guardarlos en frascos de vidrio oscuro o cubiertos de papel negro: la clorofila o materia colorante verde de las vegetales sólo se forma por la acción de la luz.
5.º Electricidad. -Es un poderoso agente así en las combinaciones como en las descomposiciones, el paso de una chispa eléctrica por una mezcla de oxígeno e hidrógeno, determina en el acto su combinación; pero en cambio no hay compuesto alguno que resista, sin descomponerse, a la acción de una corriente eléctrica. Además, si los cuerpos tienen electricidades diferentes su afinidad es grande y las combinaciones que resultan son muy estables; pero si poseen la misma electricidad difícílmente se combinan. Por razón del estado eléctrico de los cuerpos, se han hecho dos grandes divisiones, electropositivos y electronegativos, que lo son entre sí de una manera relativa como veremos más adelante.
6.º La presión. El oxígeno y el hidrógeno que son tan afines, pueden permanecer mezclados sin combinarse, pero si lo verifican sometiéndolos a una fuerte presión. Si en un tubo de hierro fuerte y resistente, se coloca caliza o carbonato de cal y se cierra herméticamente y se expone a una elevada temperatura, una pequeña parte se descompone y el gas ácido carbónico ejerce tal presión sobre la caliza, que antes se funde, que descomponerse y dejándola enfriar, al solidificarse cristaliza, no en romboedros como lo hace generalmente la caliza, sino en prismas rectangulares.
7.º La presencia de ciertos cuerpos. -La experiencia nos dice que algunos cuerpos, que no se combinan hallándose en condiciones normales, lo verifican tan pronto como se pone en contacto de ellos un tercer cuerpo que con sólo su presencia, pero sin intervenir químicamente, determina la combinación. Si en una mezcla de oxígeno de hidrógeno se introduce un poco de musgo o esponja de platino, bien pronto se pone el metal rojo de fuego, por la gran cantidad de calor que se desarrolla al condensarse los dos gases y particularmente el hidrógeno, en la asa de la esponja de platino, combinándose aquellos con detonación para formar el agua. Un poco de bioxido de manganeso mezclado con el clorato potásico en caliente, produce muy pronto la descomposición de este cuerpo, que calentado sólo, necesitaría muy alta temperatura para deseomponerse. En uno y otro caso, ni el platino ni el bioxido de manganeso han sufrido trasformación ninguna; su sola presencia produjo la acción química. Esta acción de presencia, cuya causa se ignora, se ha atribuido a una fuerza desconocida que se denomina Catalítica (del griego katalitikos que destruye o descompone.)
-II-
8. Cristalografía. -Sabemos por Física lo que se entiende por cristalización, es decir la forma regular o geométrica que afectan muchos cuerpos simples o compuestos al pasar del estado gaseoso o líquido al sólido. El estudio de todo cuanto se refiere a esas formas o cristales, constituye la cristalografía, ciencia propia del mineralogista, pero que interesa igualmente al químico, por las muchas sustancias que éste prepara y cristalizan. Tanto en la naturaleza, como en los laboratorios, los cuerpos pueden cristalizar por dos medios; el calor (vía seca) y la disolución (vía húmeda.) Los que no cristalizan de ningún modo se llaman amorfos.
A. Vía seca. -Fundido el cuerpo se le deja enfriar y cuando se ha solidificado la superficie en contacto del aire y la porción inmediata a las paredes de la vasija, se taladra la costa fría y se derrama la parte que se conserva líquida, apareciendo el fondo y las paredes tapizadas de cristales. Así pueden cristalizar muchos metales, el azufre, etc.
Si el cuerpo es susceptible de volatilizarse, se recibe el vapor en una parte fría donde se condensa y cristaliza: esta cristalización se llama por sublimación. El yodo, arsénico, azufre y muchos compuestos que conoceremos cristalizan por este medio.
B. Vía húmeda. -Si el cuerpo es más soluble en un líquido caliente que en frío; una vez disuelto, se le abandona a sí mismo y el exceso, no soluble al enfriarse, se deposita y cristaliza. Pero lo general es disolver el cuerpo y dejar que se evapore el líquido lentamente; o producir la evaporación rápida por la un foco directo de calor y la sustancia se solidifica cristalizando a medida que desaparece el disolvente. El líquido que generalmente se emplea como disolvente es el agua; pero también se usa el sulfuro de carbono y algunos otros.
Sea cual fuere el procedimiento por el cual cristalicen los cuerpos, las formas que pueden afectar son numerosas, pero todas ellas pueden reducirse a grupos determinados que reciben el nombre de sistemas cristalinos. Dentro de cada sistema hay una forma típica o primitiva de la cual se derivan obras que se llaman derivadas o secundarias. El tránsito de unas formas a otras, se verifica por truncamientos en los ángulos sólidos; biselamientos en las aristas o apuntamientos en las caras del cristal, bajo la ley llamada de simetría que dice: siempre que se modifica una parte de un cristal se modifican todas sus semejantes y, del mismo modo entendiéndose por partes semejantes las que tienen las mismas condiciones geométricas.
El número de sistemas cristalinos varía según los autores, pero lo más común es admitir con Dufrénoy, geólogo y mineralogista francés, seis tres que se consideran prismas rectos y tres oblicuos, dependientes de la inclinación y longitud de los tres ejes que se admiten en las formas típicas.
| Iguales 1.º | Sistema cúbico | |
| Tres ejes rectangulares | Dos iguales | 2.º Prismático recto de base cuadrada |
| Desiguales | 3.º Prismático recto de base rectangular | |
| Iguales | 4.º Sistema romboédrico | |
| Tres ejes rectangulares | Dos iguales | 5.º Prismático oblicuo de base romboidal |
| Desiguales | 6.º Prismático oblicuo de base paralelográmica oblicuángula |
9. Isomorfismo. Dimorfismo. -Cuando dos sustancias diferentes, pero de composición química análoga, cristalizan en la misma forma, se dice que son isomorfas (del griego isos igual y morfes forma). Si se pone un cristal de alumbre de cromo en una disolución saturada de alumbre común continúa aumentando de volumen, cubriéndose el cristal morado de cromo, de la materia incolora del alumbre ordinario: estas dos materias son isomorfas,
Si un mismo cuerpo, simple o compuesto, cristaliza en condiciones diferentes, puede afectar dos formas distintas; la sustancia se dice que es dimorfa y el fenómeno se llama dimorfismo. El azufre fundido cristaliza en prismas oblicuos y disuelto en el sulfuro de carbono, lo hace en octaedros. La caliza, por disolución en el agua, a expensas de un exceso de ácido carbónico, cristaliza en romboedros (espato de Islandia) y por la elevación de temperatura y la presión, fundiéndose, en prismas rectos de base rectangular (aragonito).
10. Alotropía. Isomería. -Un mismo cuerpo simple puede presentar propiedades físicas y químicas diferentes dando lugar a estados que se llaman alotrópicos y el fenómeno alotropía (del griego allotropos diferente). Los estados alotrópicos pueden ser dos o más: la mayor parte de los metaloides presentan esas estados, siendo notables en el fósforo. Un mismo cuerpo compuesto puede ofrecer caracteres físicos y químicos diferentes, constituyendo diversos estados isoméricos y el fenómeno isomería (del griego isomeres partes iguales). El sulfuro de mercurio sin variar de composición ni naturaleza, se presenta unas veces rojo (bermellon) y otras negro (etiope mineral). La alotropía es la isomería de los cuerpos simples y la isomería la alotropía de los cuerpos compuestos.
11. Análisis. Síntesis. -Llámase análisis química el procedimiento empleado para reconocer la naturaleza de un cuerpo o los elementos que le constituyen. El análisis puede ser cualitativa y cuantitativa: por la primera sólo se aprecia la cualidad o naturaleza de los elementos que forman el compuesto; por la segunda determinamos la cantidad en que entran a constituirle. La síntesis es el procedimiento inverso, que consiste en reunir los elementos para formar el cuerpo compuesto. Por la análisis el cuerpo se descompone, separándose sus elementos, siendo así más fácil estudiarle para conocer su naturaleza; por la síntesis se reúnen esos elementos debiendo formar de nuevo el mismo cuerpo compuesto.
Nomenclatura química
LECCIÓN 2.ª -Nomenclatura química. -Nomenclatura francesa. -Íd. de los cuerpos simples. -Íd. de los compuestos. -Íd. de Berzelius. -Íd. moderna. -Nomenclatura escrita. -Fórmulas y ecuaciones químicas.
12. Nomenclatura química. -Se llama nomenclatura química el lenguaje de la Química; es decir, el conjunto de reglas para dar nombres adecuados a todos los cuerpos simples y compuestos que estudia esta ciencia. Puede ser oral o hablada y escrita o simbólica.
Hasta fines del siglo pasado en que aparece la nomenclatura, el lenguaje de la Química era un conjunto de nombres arbitrarios y caprichosos que nada representaban; lo cual era resultado de que se desconocía la naturaleza y composición de los cuerpos así simples como compuestos, viéndose precisados a dar nombres que recordaban alguna de sus propiedades físicas o la de cuerpos con quienes presentaban alguna semejanza exterior. Los primeros fundamentos de la nomenclatura fueron expuestos por Guyton de Morveau82 por cuya razón recibió el nombre de francesa o Guytoniana, y desarrollada por Lavoisier, Berthollet83 y Fourcroy84. Nos ocuparemos primero de la nomenclatura hablada y después de la escrita.
13. Nomenclatura francesa. -Dos reglas principales se establecieron para dar nombres a los cuerpos, una relativa a los simples y otra a los compuestos. El de los simples deberá estar formado por una sola palabra que recuerde su propiedad más característica. El nombre de los compuestos consta de dos palabras que indican no sólo la naturaleza de los elementos que lo forman, sino las cantidades en que entran.
14. Nomenclatura de los cuerpos simples. -En la antigüedad los cuerpos simples metálicos tenían el nombre de alguno de los dioses del gentilismo; nombres que desaparecieron al establecerse la nueva nomenclatura: sin embargo el nombre antiguo del Mercurio ha prevalecido sobre el moderno Azogue.
| Nombres antiguos | Nombres modernos |
| Apolo | Oro |
| Diana | Plata |
| Mercurio | Azogue |
| Venus | Cobre |
| Júpiter | Estaño |
| Saturno | Plomo |
| Marte | Hierro |
En el día en el estudio de la nomenclatura en general figura mucho el estado eléctrico que ofrecen los cuerpos simples que como ya hemos indicado sólo es relativo; es decir, tal simple puede ser electro-positivo con relación a uno y electro-negativo respecto a otro, así el plomo es electro-negativo con relación al hierro y electro-positivo respecto al azufre. El oxígeno siempre es electro-negativo y el potasio siempre electro-positivo. Se ha formado pues una tabla, según el estado eléctrico, que principia con el oxígeno, el más negativo y termina con el potasio, el más positivo. El número de los cuerpos simples no puede fijarse exactamente, pues hay dudas acerca de la simplicidad de algunos: se admiten 67 que nos parecen muchos.
15. Nomenclatura de los cuerpos compuestos. -En la nomenclatura francesa se admiten dos grandes grupos de combinaciones; compuestos oxigenados y no oxigenados, resultando en definitiva tres clases de combinaciones químicas; ácidos, óxidos y sales.
1.º Compuestos oxigenados binarios.
a. Ácidos. -Se llama ácido toda combinación binaria de un cuerpo simple con el oxígeno, que presenta los caracteres de tener sabor agrio o picante, enrojecer las tinturas azules de los vegetales, como la de tornasol y en sus combinaciones con los óxidos son electro-negativos. Estos ácidos se llaman oxácidos para distinguirlos de los ácidos de hidrógeno (compuestos binarios no oxigenados) que se llaman hidrácidos.
Consta su nombre de dos palabras, una genérica ácido y otra específica formada por el cuerpo simple o radical. Si en cada orden de combinación no hubiera más que un compuesto, la nomenclatura sería muy sencilla empleando la palabra ácido seguida del cuerpo con quien está combinado, terminado en ico. Así la combinación del oxígeno con el boro, se llama ácido bórico: pero como existen más, ha habido necesidad de dar nombres para distinguirlos. Al efecto se añade a la raíz del cuerpo que se combina con el oxígeno la terminación ico si tiene la mayor cantidad de oxígeno y oso si contiene la menor. Esto fue suficiente en un principio, pero cuando se descubrieron más ácidos de una misma serie de combinaciones, se antepusieron al nombre específico las preposiciones griegas hipo (debajo) cuando el ácido tiene menos oxígeno que el terminado en ico o en oso y la per o hiper (sobre) para el más oxigenado de todos. Así los compuestos del cloro con el oxígeno son
- ácido hipocloroso
- ácido cloroso
- ácido hipoclórico
- ácido clórico
- ácido perclórico.
Creemos inútil advertir que no todos los cuerpos forman con el oxígeno el mismo número de ácidos.
Estos ácidos que carecen absolutamente de agua se llaman anhidros (del griego a sin e hidros agua) y los que la tienen hidratados La nomenclatura de estos es la misma, anteponiendo la palabra mono-hidratado o bi-hidratado, etc. según el número de moléculas de agua que contengan.
b. Óxidos. -Se llaman óxidos o bases las combinaciones de un metal con el oxígeno: a veces, aunque raras también, los simples, que no son metales, forman óxidos (óxido de carbono). Son sus caracteres, sabor de jabón o alcalino o cáustico, enverdecen las tinturas azules y devuelven el calor azul al tornasol enrojecido por un ácido; son electro-positivos con relación a los ácidos y combinados con estos forman sales. No todos los óxidos participan de estas propiedades, pues los hay neutros o indiferentes, el citado óxido de carbono que no se combina ni con los ácidos, ni con las bases.
Consta también su nombre de dos palabras, una genérica óxido y otra específica con el nombre del simple precedido de la preposición de, si fuese uno sola; así el oxígeno combinado con el carbono forma el óxido de carbono. Pero cuando se forma más de un óxido, se antepone al nombre genérico los numerales griegos proto (primero), sesqui (vez y media), bi o deuto (segundo) y per para la mayor cantidad de oxigeno: ejemplo
- Protóxido de hierro
- Sesquióxido de hierro
- Bióxido de hierro
- Peróxido de hierro
Si aún se formase un compuesto menos oxigenado que el protóxido, se antepone la sílaba sub, como en el sub-óxido de plata. También los óxidos, como los ácidos, pueden ser anhidros o hidratados. En la práctica muchas veces se prescinde del nombre químico de muchos óxidos y se designan con los vulgares y antiguos; así al protóxido de potasio se le llama simplemente potasa, al de calcio cal, al de magnesio, magnesia, al de aluminio, alúmina.
2.º Compuesto oxigenados ternarios.
a. Sales. -Figuran entre los compuestos oxigenados terriarios como más importantes las gases o combinaciones de un ácido, oxácido, con un óxido por lo que se llaman oxixales. En esta nomenclatura el género le constituye el ácido o elemento electro-negativo y la especie el positivo o sea el óxido o base. Como el ácido que forme la sal puede ser el terminado en ico o en oso, en el primer caso la terminación se cambia en ato y en el segundo la oso en ito. Ejemplo:
ácido nítrico con protóxido de potasio; nitrato de protóxido de potasio
ácido nitroso con protóxido de bario; nitrito de protóxido de bario.
Es común para abreviar suprimir la palabra óxido, diciendo solamente sulfato de potasio, nitrato de plata.
Las sales pueden ser neutras si el ácido y la base entran en iguales proporciones; ácidas si predomina el ácido y básicas si domina la base. En el primer caso su nomenclatura es la indicada; pero si la sal es ácida, se antepone al nombre genérico la palabra sobre o se pospone el nombre ácido; como sobresulfato de potasio o sulfato ácido de potasio: y para indicar las proporciones en que entra el ácido con relación a la sal neutra se antepone la palabra sesqui, bi, etc.: ejemplo; sesqui-carbonato de potasio, bi-carbonato de sodio. Si la sal es básica se precede o sigue al nombre genérico, sub o básico; como sub-sulfato de hierro o sulfato básico de hierro; y la proporción en que entra la base se indica anteponiendo a la palabra básico, sesqui, bi, etc.; ejemplo fosfato sequi-básico de calcio.
Si son dos óxidos los que se combinan dan también origen a una oxisal en que el óxido más oxigenado hace el papel de ácido y el menos el de base; ejemplo, óxido de aluminio con óxido de cobalto, aluminato de óxido de cobalto. También pueden combinarse dos sales y dan origen a las sales dobles, ejemplo, sulfato de alúmina con sulfato de potasio forma el sulfato doble de alúmina y potasa.
3.º Compuestos no oxigenados binarios.
-Pueden ser ácidos o neutros.
a. Ácidos. -Están formados por el hidrógeno y un simple no metal o por dos cuerpos simples. En el primer caso el nombre genérico es también la palabra ácido y el específico termina en hídrico; ejemplo ácido clorhídrico. En el segundo caso, termina en ico, como ácido fluo-bórico.
b. Compuestos neutros. -Están formados por un cuerpo simple electronegativo y un metal o por dos cuerpos simples. Se designan terminando el nombre genérico, que lo forma el cuerpo más electronegativo, en uro; así se dice fósfuro de hidrógeno, cloruro de azufre, yoduro de plata. Si hay varios de una misma combinación, se distinguen anteponiendo las palabras proto, sesqui, bi etc. protocloruro de hierro, sesquicloruro de hierro, percloruro de hierro.
Si los compuestos son gaseosos, es más común anteponer el nombre del hidrógeno al cuerpo simple que se termina en ado; hidrógeno carbonado. El nitruro de hidrógeno conserva su nombre vulgar de amoniaco y el nitruro de carbono se llama simplemente cianógeno.
4.º Compuestos no oxigenados ternarios. -Son resultado de la combinación de dos binarios, uno de ellos hidrácido, que tienen un elemento común, formando una verdadera sal, por cuya razón se designan como las oxisales, terminándolas en ato; ejemplo sulfhidrato de sulfuro de potasio.
5.º Aleaciones. -Se llaman aleaciones o ligas las combinaciones de dos o más metales; se designan nombrando los metales empezando por los más negativos o indicando las proporciones en que entran; ejemplo, dos partes de estaño y una de plomo. Si uno de los metales que entran en la combinación es el mercurio, el compuesto se llama amalgama y se cita solo el metal o metales que le acompañan; amalgama, de estaño.
16. Nomenclatura de Berzelius85. -Este ilustre químico admitiendo muchos de los fundamento de la nomenclatura francesa, la modificó sin embargo, poniéndola más en armonía con los nuevos descubrimientos hechos hasta su época. Empezó por dividir los cuerpos simples, en metaloides y metales y estos en electro-positivos y electro-negativos. Son metaloides los cuerpos simples sin brillo, ni aspecto metálico, electro-negativos con relación a los metales y al combinarse con el oxígeno dan por punto general ácidos. Muchos son sólidos y otros gaseosos a la temperatura y presión ordinaria y uno solo líquido el bromo. Los metales son cuerpos de brillo y aspecto metálico, buenos conductores del calor y la electricidad, electropositivos con relación a los metaloides, y al unirse al oxígeno forman por lo general óxidos o bases. Todos son sólidos a la temperatura ordinaria, excepto el mercurio. A pesar de caracteres tan opuestos, no están de acuerdo los autores sobre la colocación de algunos cuerpos, como el arsénico y el antimonio, que unos ponen entre los metaloides y otros entre los metales: por su brillo, su pesantez, su modo de alearse con otros metales, en una palabra por sus propiedades físicas son metales, pero por sus combinaciones con el oxígeno, hidrógeno y otros cuerpos, es decir por sus propiedades químicas son verdaderos metaloides.
Los químicos modernos prescinden de esta clasificación. Admite Berzelius las tres clases de compuestos, ácidos, óxidos y sales. La nomenclatura de los ácidos es idéntica a la francesa: la de los óxidos la hace bajo las mismas, reglas que la de los ácidos, es decir terminando el nombre específico en oso o en ico y para compuestos de un mismo orden en que las proporciones sean mayores o menores, antepone al nombre genérico la palabra sobre o sub; así para el cobre si existiesen todos los compuestos que se pueden designar, serían
- Sub-óxido cuproso,
- óxido cuproso.
- Sub-óxido cúprico,
- óxido cúprico.
- Sobre-óxido cúprico.
Respecto de las sales las divide en alógenas o aloideas y ánfidas o anfigenas. Las primeras están formadas por un metaloide cuerpo alógeno86 y un metal y terminan en uro; pero para distinguir los diferentes compuestos de una misma combinación, siguiendo el sistema establecido para los ácidos y los óxidos, termina también estas sales en oso y en ico y usa también los palabras sub y sobre; ejemplo
- Sub-cloruro ferroso,
- cloruro ferroso,
- Sub-cloruro férrico,
- cloruro férrico,
- Sobre-cloruro ferrico.
Las sales ánfidas están formadas por un ácido y un óxido y su nomenclatura es la ya indicada respecto las oxisales; con la sola excepción que en las básicas, va precedido el nombre genérico de la palabra sub y el específico de las sesqui, bi etc., ejemplo. sub-nitrato triplúmbico, y en cuanto a las sales neutras se adjetiva el nombre específico terminándole en ico; sulfato alumínico, nitrato potásico.
17. Nomenclatura moderna. -En esta nomenclatura, arreglada a la teoría unitaria, de que hablaremos en la lección inmediata, a los ácidos se les denomina anhídridos, si se producen haciendo perder el agua a los ácidos oxigenados, ternarios ejemplo anhídrido sulfúrico, anhídrido nítrico. En cuanto a las sales ternarias se las termina también en ato o ito, pero agregando sólo el metal, que en esta teoría se supone reemplaza al hidrógeno que entra a formar el ácido, así el ácido sulfúrico, constituido por hidrógeno, azufre y oxígeno, se combina con el potasio y forma sulfato de potasio, formado de potasio, azufre y oxígeno.
18. Nomenclatura escrita. -Tiene por objeto representar de una manera abreviada los cuerpos simples y compuestos y las reacciones químicas que producen al obrar unos sobre otros. Para representar los cuerpos simples, se emplea la letra inicial del nombre tomado del latín, lo cual constituye su signo, o símbolo químico; y si hubiera dos o más que empezasen con la misma letra se conserva esta para el conocido de más antiguo y, para los demás, se une a la inicial la segunda o la tercera; ejemplo, el carbono, cloro, calcio, cromo, cobre, serán sus símbolos C -Ci -Ca -Cr -Co.
19. Fórmulas y ecuaciones químicas. -La fórmula de los cuerpos compuestos se representa con los símbolos de los simples que les forman. Si el compuesto, es una sal, según la antigua nomenclatura (teoría dualística) se escribe primero el elemento positivo (el óxido) y después el negativo (el ácido) separados por una coma y en la teoría moderna (unitaria) se escribe primero el signo del metal (siempre el elemento positivo, al revés de como se pronuncia) y después el ácido, figurando el último el oxígeno; y las cantidades en que entran los elementos, por medio de un número a manera de exponente, aunque en la moderna formulación se coloca en la parte inferior.
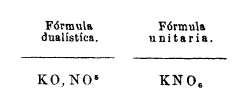
Si de un mismo cuerpo compuesto entran dos o más átomos, se indican por un número en forma de coeficiente
3 K O, N O5
Una reacción química, se representa por medio de una ecuación, en cuyo primer miembro figuran los cuerpos que reaccionan, ligados por el signo +; y en el segundo el resultado de la reacción
Zn + S O3 + H O = Zn O, S O3 + H
LECCIÓN 3.ª Teorías químicas. -Teoría del flogisto. -Teoría de los equivalentes o ley de Wenzel. -Hipótesis de Proust. -Ley de Dalton o de las proporciones múltiplas. -Teoría atómica. -Teoría termo-química. -Teoría dualística. -Teoría electro-química. -Teoría unitaria. -Teoría sobre la materia.
20. Teorías químicas y leyes que presiden a las combinaciones. -Grandes esfuerzos han hecho los químicos de todos tiempos para poder explicar la constitución y naturaleza de los cuerpos compuestos y qué fuerza o qué causa es la que obliga a las moléculas a penetrarse para dar origen a las combinaciones; y las leyes bajo las cuales éstas se verifican. Desde la antigua teoría del flogisto hasta la moderna teoría unitaria, han sido muy diversas las hipótesis propuestas para explicar la fuerza de combinación y variadas las leyes que acerca de ella han sido halladas hasta el dia. Vamos, pues, dentro de los límites que permiten unas sencillas nociones de Química, a dar una ligera idea de las principales teorías, cuyo desarrollo corresponde a los estudios de la ampliación de esta ciencia.
21. Teoría del flogisto. -Débese a Sthal87 a fines del siglo XVII, la primera teoría química que con algún fundamento racional dominó durante largo tiempo en esta ciencia, no menos que en la Medicina. Teoría que fue recibida con entusiasmo y de tal modo aceptada por todos los hombres de ciencia de aquella época, que evidenciados sus errores, fue preciso todo el peso de la autoridad de los sabios más eminentes de fines del siglo XVIII, para olvidarla.
El flogisto era algo que salía de los cuerpos en sus combinaciones, particularmente en la combustión; era por lo tanto el calor. Así se decía que el flogisto (del griego phlegoo quemar) o el fuego o el calor asociado a ciertos cuerpos producía determinadas combinaciones. Se admitía que existían cuerpos muy ricos en flogisto, como el carbón, el azufre, el fósforo y que por esta razón ardían muy fácilmente.
Los metales se les creía formados por cales y flogisto, de modo que al colocar un metal en una elevada temperatura, al arder o quemarse, su flogisto se convertía en calor y luz y desaparecía quedando sólo la cal; es decir, que el metal, por la combustión, se convertía en una cal. Hoy se dice que un metal al quemarse se combina con el oxígeno del aire y se convierte en un óxido, cal de los antiguos. Y por el contrario, cuando una cal según esta teoría, se combinaba con el flogisto, formaba el metal: hoy se dice que cuando una cal (óxido) se somete a la acción del fuego (flogisto) ya directamente, ya mezclado con una sustancia que le prive de su oxígeno, como el carbón, se reduce al estado metálico, porque pierde su oxígeno y se convierte en metal.
Desde luego se echa de ver el débil fundamento de esta teoría, al considerar que los metales al arder en contacto del aire, en vez de perder flogisto y disminuir de peso, por el contrario adquieren algo (oxígeno) que les hace aumentar de densidad. La gloria de haber desecho todo el artificio de esta teoría, que no se apoya en análisis bien probados, pertenece al ilustre Lavoisier que demostró concluyentemente que el oxígeno es quien se combina con los metales formando óxidos o cales, los que sometidos a una alta temperatura, en presencia de un cuerpo desoxidante éste se apodera del oxígeno y deja en libertad el metal.
22. Teoría de los equivalentes. -Ley de Wenzel. -A mediados del siglo XVII, Glauber88 dio a conocer diferentes hechos que fueron como bases ciertas en que más tarde se apoyaron teorías de la importancia de la de los equivalentes y que iniciaron los fundamentos científicos de la Química moderna. Observó aquel químico, que el ácido sulfúrico sustituía al ácido nítrico en sus combinaciones en cantidades determinadas y que dos sales después de descomponerse mutuamente, conservan el estado neutro en los nuevos compuestos que resultan. Estos y otros hechos sirvieron a Wenzel89 para establecer la ley que lleva su nombre y que puede enunciarse, las cantidades de muchos ácidos que neutralizan un peso dado de una base, son proporcionales a las cantidades que se necesitan de los mismos ácidos para neutralizar un peso determinado de otra base. Es decir que si se tienen varios pesos B -B'- B'' -B'''... de otras tantas bases, que pueden ser neutralizadas por un
un peso A de un ácido; si A' -A'' -A'''... son los pesos de varios ácidos que neutralizan un peso de base B; las cantidades de los ácidos A' -A'' -A'''... neutralizarán igualmente las proporciones de las bases B'- B'' -B'''... He aquí la razón del nombre equivalentes: porque siempre que ciertas cantidades en peso de materia, sustituyen a otras en sus combinaciones, se dice que son equivalentes a ellas. Llámase, pues, equivalente químico, la cantidad en peso que se necesita de un cuerpo para que reemplace o sustituya a otro en las combinaciones. Ejemplo: si sobre una cantidad de agua compuesta de 8 gr. de oxígeno y 1 de hidrógeno, se hace obrar el metal potasio, la experiencia demuestra que se necesitarán 39 gr. del metal para desalojar el 1 de hidrógeno y combinarse con los 8 de oxígeno, dando origen a 47 de óxido de potasio (potasa). Si queremos convertir aquel compuesto en óxido de sodio (soda), necesitaríamos 25 de sodio que desalojarán al 1 de hidrógeno, combinándose con los 8 gr. de oxígeno, resultando 31 de óxido de sodio; y si deseáramos transformar éste en óxido de hierro, sería necesario emplear 28 gr. de este último metal: estas cantidades en peso,
1 -39 -25 -28
son, pues, los equivalentes de los cuerpos
hidrógeno -potasio -sodio -hierro.
Estos números han recibido también el nombre de números proporcionales, es decir, números que representan los pesos de los cuerpos que entran en las combinaciones y que guardan una proporción constante en los diferentes pesos de un mismo compuesto.
No siendo el equivalente de un cuerpo una cantidad absoluta, ha sido preciso tomar otro cuerpo que sirva de unidad: en un principio se tomó el oxígeno como tipo y su equivalente se supuso igual a 100; en el día la mayor parte de los químicos toman como unidad el hidrógeno, cuyo equivalente hacen igual a 1. En cuyo caso el equivalente del oxígeno comparado con el del hidrógeno es 8; luego será equivalente de un cuerpo simple la cantidad en peso de dicho cuerpo que se combina con 8 de oxígeno para formar el primer compuesto oxidado. El equivalente de un cuerpo simple se puede determinar procediendo al análisis o del primer compuesto oxidado para conocer su composición en peso, averiguado lo cual es fácil hallar el equivalente. Sean por ejemplo 100 de óxido de plata que se descomponen por la acción del calor, quedando 93'1 de plata, desapareciendo 6'9 que eran de oxígeno que se ha separado y siendo el equivalente de este cuerpo 8 y x el del cuerpo que se desea conocer, tendremos
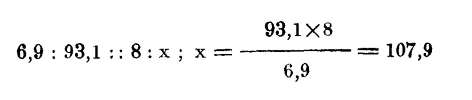
equivalente de la plata.
El equivalente de los cuerpos compuestos es igual a la suma de los equivalentes de los simples que entran a formar el compuesto; así los equivalentes del agua y del ácido clorhídrico, serán respectivamente

23. Hipótesis de Proust. -El Doctor inglés Proust admite que el equivalente de todo cuerpo simple es múltiplo del equivalente del hidrógeno o de un medio o un cuarto del mismo. Esta ley sin embargo parece que no es rigurosamente exacta.
24. Ley de Dalton o de las proporciones múltiples. -La teoría que Dalton expuso el año de 1807 en su obra Nuevo sistema de filosofía química, se conoce hoy con el nombre de ley de las proporciones múltiples y se expresa, cuando dos cuerpos se combinan para formar diferentes compuestos, mientras la cantidad de uno de ellos permanece constante, las proporciones del otro son siempre el producto de la multiplicación por 1, por 2, 3, 4 etc. del primero.
Ejemplo. Los cinco compuestos de nitrógeno y oxígeno, están en las proporciones siguientes:
- 14 de nitrógeno con 8 de oxígeno = 1 x 8
- 14 de nitrógeno con 16 de oxígeno = 2 x 8
- 14 de nitrógeno con 24 de oxígeno = 3 x 8
- 14 de nitrógeno con 32 de oxígeno = 4 x 8
- 14 de nitrógeno con 40 de oxígeno = 5 x 8
25. Teoría atómica. -Parte, como toda teoría, de varias hipótesis: l.ª Los cuerpos están formados de átomos. 2.ª Los átomos de un mismo cuerpo tienen igual peso, invariable y 3.ªla combinación de los cuerpos resalta de la yuxtaposición de los átomos.
Las dos primeras hipótesis las admite la Físíca y con ellas se explican muchos hechos o fenómenos; la 3.ª la demuestra la Química. Esta teoría explica el porqué de las combinaciones según los equivalentes, pues los pesos de los átomos de los cuerpos simples, son en general como sus equivalentes. Varias leyes confirman, esta teoría, principalmente la ley de Ampere y la de Gay-Lussac. La primera relativa a las combinaciones de los gases dice que a igualdad de volúmenes, de presión y de temperaturas todos los gases encierran el mismo número de átomos, luego todos los átomos de un mismo gas, tienen igual peso. La ley de Gay-Lussac dice que cuando dos gases se combinan, sus volúmenes guardan una relación muy sencilla entre sí y con el volumen del compuesto resultante, hallándose a la misma presión y temperatura. Esta ley se llama también de los volúmenes. Como consecuencia de ella hay que agregar. l.º que nunca el volumen del gas vapor formado es mayor que la suma de los volúmenes de los gases componentes. 2.º que cuando los gases se combinan en volúmenes iguales, el que resalta es igual a la suma de los volúmenes de los gases simples que forman el compuesto y 3.º si se combinan en volúmenes desiguales, el volumen que resulta es menor; es decir, que hay contracción. Ejemplo:

Esta teoría ha sido sostenida por el célebre Berzelius. Gerhardt90 la modificó, asignando tan sólo a los pesos atómicos de los metales, la mitad de lo propuesto por Berzelius y admitió no sólo el átomo, sino la molécula que supone formada por dos átomos. Además que los cuerpos compuestos no tienen peso atómico por ser su parte más pequeña la molécula; entonces se toma el peso de ésta o sea el peso molecular, que se obtiene en cualquier cuerpo que sea gaseoso, multiplicando su densidad con relación al aire, por 28'88, número que es dos veces la relación entre la densidad del aire y la del hidrógeno.
Si se considera como equivalente de un cuerpo, su peso atómico, entonces aparece la ley de Dulong y Petit que dice que el peso atómico de un cuerpo multiplícado por su calórico específico, es igual a una cantidad constante, llamada calor atómico y vale 6'4: multiplicando, pues, este número por el calor específico de los cuerpos, se obtiene su peso atómico. Y así como el hidrógeno se ha tomado como unidad de comparación para los equivalentes, tambíen lo es para los pesos atómicos. Esta unidad de peso se refiere al litro de hidrógeno que pesa 0'0896 gramos, unos 9 centigramos y se ha llamado kritha (gramo); un libro, pues, de hidrógeno pesa una kritha y una de sus moléculas, puesto que son dos átomos, dos krithas.
26. Teoría termo-química. -La constituyen varias leyes, deducidas de los calores específicos aplicados a las combinaciones químicas. Estas leyes son:
a. De Dulong y Petit. -Todos los átomos de los cuerpos simples tienen el mismo calor específico.
b. De Regnault. -En los cuerpos compuestos de igual constitución atómica y química, los calores específicos están en razón inversa de sus pesos moleculares.
c. De Neumann y Kopp. -El calor molecular de un cuerpo compuesto, es igual a la suma de los calores atómicos de sus elementos constitutivos.
27. Teoría dualística. -Puede considerarse como la primera teoría cientifica que intentó explicar el modo cómo se hallan agrupadas las moléculas que constituyen los cuerpos compuestos. Establecida por Guyton de Morveau y Lavoisier, al fundar la nomenclatura que pretendían estuviese basada sobre la constitución de los cuerpos, fue desde luego admitida por todos los químicos y brillantemente sostenida por Berzelius, por más que en el modo de formular, como hemos visto, no estuviese conforme el ilustre químico alemán, con los franceses. En esta teoría los cuerpos compuestos o son binarios, ternarios o cuaternarios. Los binarios están formados de dos elementos, como el
| oxígeno | |
| óxido de sodio | |
| sodio |
Los ternarios de dos binarios, en los cuales entra un elemento común

Los cuaternarios de dos ternarios en que hay dos elementos comunes

Hay, pues, en toda combinación, según esta teoría, dos elementos o mejor dos fuerzas que determinan la unión de los cuerpos que, dos a dos, forman los compuestos. Por eso ha recibido el nombre de teoría dualística.
28. Teoría electro-química. -Esta teoría ha venido a confirmar la dualística. Aunque se conocen varias teorías electro-químicas, todas ellas intentan explicar la afinidad o fuerza de combinación por el estado eléctrico de los cuerpos o que la electricidad es la causa de todos los fenómenos químicos. Tres son las teorías electro-químicas que se conocen, la de Davy, la de Ampere y la de Berzelius, siendo esta última la que mejor explica los fenómenos químicos. Berzelius parte, para establecer su teoría, de los fenómenos que se observan en la electrización de varios cuerpos principalmente la turmalina, que ya sabemos por Física que se electriza por el calor y adquiere las dos electricidades que se acumulan en los extremos del cuerpo formando como sus polos; pues una electrización y polaridad semejante supone Berzelius que tienen los átomos de los cuerpos; admitiendo 1.º que los átomos de que están, constituídos los cuerpos tienen la misma propiedad que la turmalina, un polo positivo y otro negativo; 2.º los polos de los átomos pueden tener distinta intensidad eléctrica. Según esto un cuerpo puede ser electro-positivo o electro-negativo, según la intensidad eléctrica de sus polos; más no será siempre, como ya hemos dicho (14) electro-positivo o electro-negativo, sino relativamente y según el cuerpo con quien se combine.
Resumiendo ahora cuanto dejamos expuesto acerca de los cuerpos simples, sus símbolos, equivalentes, y estado eléctrico, lo indicamos en el cuadro adjunto.
CUADRO DE LOS CUERPOS SIMPLES
| Número de orden | Nombres de los cuerpos simples | Signos | Equivalentes Hidróg.º = 1 | Clasificación electro-química | |
| 1 | Aluminio | Al. | 13'7 | O. | |
| 2 | Antimonio | Sb. | 122'6 | Fl. | |
| 3 | Arsénico | As. | 75 | Cl. | |
| 4 | Azufre | S. | 16 | Br. | |
| 5 | Bario | Ba. | 68'5 | I. | |
| 6 | Bismuto | Bi. | 212 | S. | |
| 7 | Boro | Bo. | 10'8 | Se. | |
| 8 | Bromo | Br. | 80 | Ph. | |
| 9 | Cadmio | Cd. | 55'7 | N. | |
| 10 | Calcio | Ca. | 20 | C. | |
| 11 | Carbono | C. | 6 | Bo. | |
| 12 | Cerio | Ce. | 47'2 | Si. | |
| 13 | Cesio | Cs. | 133'4 | As. | |
| 14 | Cloro | Cl. | 35'4 | Cr. | |
| 15 | Cobalto | Co. | 29'4 | Va. | |
| 16 | Cobre | Cu. | 31'6 | Mo. | |
| 17 | Cromo | Cr. | 26'2 | W. | |
| 18 | Didimio | Di. | 49'6 | Sb. | |
| 19 | Donario | Do. | 49'6 | Te. | |
| 20 | Erbio | Er. | 49'6 | Pp. | |
| 21 | Estaño | Sn. | 58'8 | Il. | |
| 22 | Estroncio | Sr. | 43'8 | Nb. | |
| 23 | Flúor | Fl. | 19'1 | In. | |
| 24 | Fósforo | Ph. | 31 | Ta. | |
| 25 | Glucinio | Gl. | 7 | Au. | |
| 26 | Hidrógeno | H. | 1 | H. | |
| 27 | Hierro | Fe. | 28 | Os. | |
| 28 | Ilmenio | Il. | 60'2 | Ru. | |
| 29 | Indio | In. | 36 | Ir. | |
| 30 | Iodo | I. | 127 | Pt. | |
| 31 | Iridio | Ir. | 98'5 | Rh | |
| 32 | Lantano | La. | 48 | Pd. | |
| 33 | Litio | Li. | 7 | Ag. | |
| 34 | Magnesio | Mg. | 12 | Hg. | |
| 35 | Manganeso | Mn. | 27'5 | U. | |
| 36 | Mercurio | Hg. | 100 | Cu. | |
| 37 | Molibdeno | Mo. | 48 | Bi. | |
| 38 | Niobio | Nb. | 49 | Sn. | |
| 39 | Níquel | Ni. | 29'5 | Pb. | |
| 40 | Nitrógeno | N. | 14 | Cd. | |
| 41 | Oro | Au. | 98'2 | Zn. | |
| 42 | Osmio | Os. | 99'4 | Ni. | |
| 43 | Oxígeno | O. | 8 | Co. | |
| 44 | Paladio | Pd. | 53'2 | Fe. | |
| 45 | Pelopio | Pp. | 53'2 | Mn. | |
| 46 | Plata | Ag. | 108 | Ce. | |
| 47 | Platino | Pt. | 98'5 | La. | |
| 48 | Plomo | Pb. | 103'5 | Di. | |
| 49 | Potasio | K. | 39'1 | Er. | |
| 50 | Rodio | Rh. | 52'1 | Tr. | |
| 51 | Rubidio | Rb. | 85'3 | Do. | |
| 52 | Rutenio | Ru. | 51'6 | Th. | |
| 53 | Selenio | Se. | 59'6 | Zr. | |
| 54 | Silicio | Si. | 28'3 | Yt. | |
| 55 | Sodio | Na. | 23 | Gl. | |
| 56 | Talio | Tl. | 204 | Al. | |
| 57 | Tántalo | Ta. | 92 | Mg. | |
| 58 | Teluro | Te. | 64 | GA. | |
| 59 | Terbio | Tr. | 64 | Ca. | |
| 60 | Titano | Ti. | 25'1 | Sr. | |
| 61 | Torinio | Th. | 59'5 | Ba. | |
| 62 | Tungsteno | W. | 92 | Li. | |
| 63 | Urano | U. | 60 | Tl. | |
| 64 | Vanadio | Va. | 68'4 | Cs. | |
| 65 | Ytrio | Yt. | 32'2 | Rb. | |
| 66 | Zinc | Zn. | 33 | Na. | |
| 67 | Zirconio | Zr. | 33'6 | K. |
29. Teoría unitaria. Teoría sobre la materia. -La teoría unitaria o moderna, antítesis de la dualística se halla enlazada con la teoría acerca de la constitución de la materia, de que ya hemos hecho una indicación en el tratado del calor. Según ella no existe más que una sola clase de materia o la materia es una, la que más o menos condensada o según la colocación que tomen sus moléculas, así origina los diferentes estados de los cuerpos y hace que estos tengan muy diversas propiedades y caracteres físicos y químicos. Confirman esta teoría multitud de hechos, entre los que citaremos 1.º la sencillez con que en todas sus creaciones procede la naturaleza, dando origen con sólo escasos elementos o cuerpos simples a gran número de variados cuerpos: 2.º la ley de la gravedad que es igual jara todos los cuerpos: 3.º que la mayor parte de los cuerpos simples tienen un mismo peso atómico o sus pesos atómicos son múltiplos entre sí. Partiendo del movimiento vibratorio de las moléculas de los cuerpos, sostienen los partidarios de la unidad de la materia que las diferentes propiedades que presentan los cuerpos son debidas a la mayor o menor rapidez o velocidad de las vibraciones de que están animadas las moléculas o partes infinitamente pequeñas que forman los átomos, partes a que Graun llama ultimatos.
La teoría unitaria considera a los cuerpos en dos grandes categorías; los que entran en las combinaciones en un solo átomo, a que se da el nombre de Mónadas y los que figuran por átomos dobles Díadas.

En esta teoría, no sólo los fundamentos en que descansa, sino hasta la formulación y el lenguaje se apartan y son opuestos a los de la teoría dualística, como hemos tenido ocasión de ver.(17-19) Y así como en aquella se atribuye al oxígeno un gran papel en las combinaciones, así en la nueva teoría es el hidrógeno, a quien se considera como un metal, el que juega principalmente en las reacciones químicas. Así un ácido en esta teoría es un compuesto hidrogenado que tratado por el hidrato de potasio, produce agua y un compuesto análogo al ácido, sólo que en vez de hidrógeno tiene potasio,
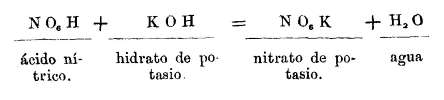
Y una sal es un ácido en que el hidrógeno ha sido sustituido por un metal.
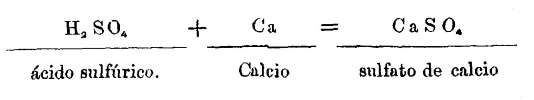
Además en la teoría unitaria las fórmulas de los cuerpos compuestos se refieren a los volúmenes: de modo que en la dualística la fórmula del hidrato de óxido de potasio es K2 O, H2 O y en la unitaria KOH: el agua, pues desaparece aquí y no hay tales hidratos, porque para formar la molécula agua se necesitan dos átomos de hidrógeno.
Han venido a apoyar la teoría unitaria, la de los tipos y la de la atomicidad. Llámase atomicidad la fuerza de combinación de los átomos. Si es un átomo el que se combina el cuerpo se llama monoatómico (cloro) si dos, diatómico (oxígeno) si tres triatómico (nitrógeno). Sin embargo no expresando estas palabras claramente la fuerza de combinación, se ha sustituido por la cuantivalencia o dinamicidad: el cloro es monovalente o monodinamo: el oxigeno divalente o didinamo y el nitrógeno trivalente o tridinamo.
La cuantivalencia se representa en la formulación por apóstrofes '' ''' y si pasan de tres por números romanos: Ph.v