Oxígeno
LECCIÓN 4.ª -Oxígeno. -Propiedades. -Obtención. -Ozono. -Combustión. -Llama. -Soplete. -Acción del oxígeno sobre la vida animal y vegetal.
30. Oxígeno. -Fue descubierto por Priestley91 en1774 según unos y por Scheele según otros92; pero quien le estudió detenidamente y dio a conocer su naturaleza fue Lavoisier. En un principio se le llamó aire deflogisticado, pero en la nueva nomenclatura se le dio el de oxígeno (engendrador de ácidos) en la creencia de que él sólo formaba estos compuestos. Se presenta en dos estados alotrópicos distintos; oxígeno normal u ordinario y oxígeno electrizado u ozono.
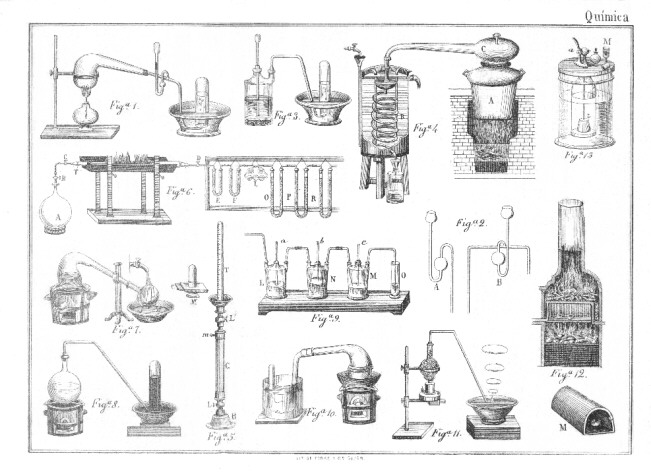
A. Propiedades. -El oxígeno normal es gaseoso a la temperatura y presión ordinarias pero a una presión de 470 atmósferas y temperatura de 100º bajo cero, ha conseguido recientemente liquidarle, Roul Pictet, de Ginebra. Es inodoro e insípido; más pesado que el aire; su densidad es de 1'1056; su equivalente 6. El agua disuelve
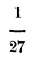
de su volumen de este gas. Se combina con más o menos energía con todos los cuerpos simples: no arde pero activa de un modo notable la combustión; no es pues combustible, pero sí comburente. Si en una campana que contenga oxígeno se introduce una cerilla que, recién apagada, conserve un punto en ignición vuelve a arder con llama más brillante. Esta combustión se hace aún más notable con el carbono, el fósforo, el hierro y otros cuerpos, que arden en el oxígeno produciendo luz viva e intensa. La combustión del hierro en el oxígeno puro es una de las más curiosas experiencias químicas. En un frasco que contenga oxígeno se introduce un espiral de hierro que en su extremo tenga un poco de yesca encendida, inmediatamente la combustión se comunica al hierro, produciendo una iluminación brillantina. El oxígeno que se halla en el aire, es el elemento indispensable para la respiración, y por lo mismo para la vida. Este gas abunda extraordinariamente en la naturaleza, forma parte del agua, del aire y de numerosas combinaciones.
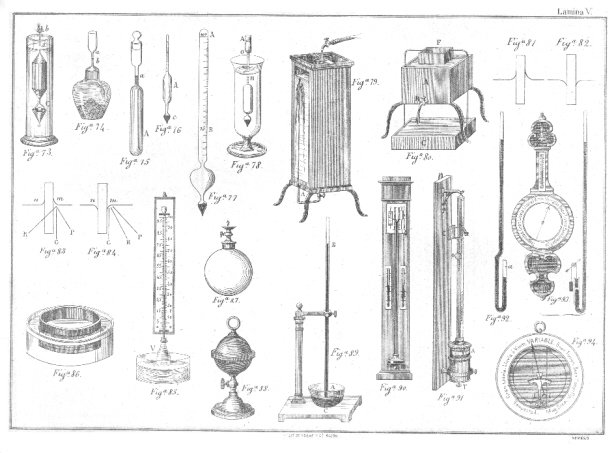
B. Obtención. -Muchos procedimientos se conocen para obtener el oxígeno, pero en lo general en las cátedras de Química elemental, se extrae del clorato de protóxido de potasio, al que se agrega una cortísima cantidad de bióxido de manganeso, que por una acción de presencia acelera la descomposición del clorato. Se pone la mezcla en una retorta de vidrio poco fusible (fig. 1.ª) y en su cuello se adapta por medio de un tapón de corcho o de catchú un tubo llarnado abductor (del latín ab hacia y ducere conducir) que sirve para conducir el gas a una cuba de agua llamada hidro-neumática, que puede ser de vidrio o de porcelana, pero, que en general es de madera forrada de zinc y lleva en su parte superior, pero cubierta por el agua una tabla con varios agujeros, llamada puente sobre el que se colocan las campañas o frascos, llenos también de agua, que han de recoger el gas. En un punto del tubo abductor hay el de seguridad, tubo encorvado que contiene unas gotas da mercurio y en su parte media lleva una bola que termina en un embudo. Tiene por objeto este tubo dar seguridad al aparato, para evitar la rotura cuando terminada la operación y disminuyendo la presión interior del aparato, la presión atmosférica obliga al mercurio a bajar a la bola, pudiendo entonces penetrar el aire, evitándose así que lo haga el agua fría de la cuba93. Calentada la sal con una lámpara de alcohol, empieza por licuarse en su agua de cristalización (fusión acuosa), luego se funde (fusión ígnea) y por último se descompone, desprendiéndose el oxígeno. No deben recogerse las primeras porciones del gas porque vienen mezcladas con el aire de interior del aparato. La reacción que se ha verificado es la siguiente:
K 0, Cl 05 = K Cl + 06 94
31. Ozono. -Es un gas incoloro, de olor parecido al del fósforo o al que se nota en el aire en el paso de una chispa eléctrica, debido precisamente a que el oxígeno del aire se electriza y se convierte en ozono; de aquí su nombre (del griego ozoo tengo olor). Su densidad es igual a 4: ataca a la plata, lo que no hace el oxígeno normal y desaloja al yodo de sus combinaciones; de manera que si se tiene engrudo de almidón con yoduro potásico en presencia del ozono, inmediatamente se colora de azul, lo que prueba que el yoduro se ha descompuesto, apoderándose el ozono del metal y combinándose el yodo con el almidón, dando origen a un compuesto azul que algunos llaman yoduro de almídon. Se obtiene por varios medios; uno de ellos por la acción del ácido sulfúrico en frío sobre el bióxido de bario.
32. Combustión. -Diose el nombre de combustión en la época de Lavoisier, a la combinación del oxígeno con un cuerpo cualquiera, con desprendimiento de calor y luz: pero como hay combustiones en que no entra el oxígeno, en el día se llama combustión a toda combinación en que se desarrolla calor y luz. Sin embargo en la mayor parte de los casos, con raras excepciones, es el oxígeno del aire el elemento comburente de las combustiones.
33. Llama. -Es toda materia gaseosa calentada hasta el punto de hacerse luminosa. De donde se deduce que los cuerpos en combustión que no producen gases, no dan llama; tal sucede al hierro por enrojecido de fuego que se encuentre y la mayor parte de las piedras. El poder iluminante de la llama depende del producto de la combustión: si este es volátil o gaseoso la llama es débil y pálida, como en la combustión del hidrógeno, cuyo producto es agua en vapor; si el producto es fijo o sólido la llama es viva y brillante, tal sucede en el gas del alumbrado y el petróleo, cuyo producto de la combustión es el carbono. En la llama hay que considerar cuatro partes; 1.ª la porción inferior azulada que la forma el óxido de carbono que se quema, 2.ª la parte oscura interior que es el depósito de los gases que todavía no se han quemado y permanece fría, o sin calor ni luz, 3.ª la parte exterior brillante que es la verdadera llama y 4.ª otra porción luminosa sumamente tenue y apenas perceptible que envuelve toda la llama. Que la parte oscura de la llama está fría, se demuestra poniendo en el extremo de una varilla mala conductora del calor y que no arda, la cabeza de una cerilla fosfórica e introduciéndola en esa porción oscura de la llama, allí permanece bastante tiempo sin arder.
Además si se corta la llama por esa parte oscura con una tela metálica, los gases pasarán sin quemarse a través de la malla de la tela; pero sí se les podrá inflamar por la parte exterior de la misma, aproximando una bujía encendida. En este sencillo hecho estriba una de las aplicaciones más importantes ideada por Davy, en la llamada lámpara de seguridad o de mineros o lámpara de Davy, con la cual se hace difícil la inflarnación de los gases que se desprenden en el interior de las minas de carbón.
34. Soplete. -Como el calor desarrollado en la combustión depende, no de la cantidad de combustible o cuerpo que se quema, sino de la cantidad de comburente o sea del oxígeno, puede aumentarse de un modo extraordinario la temperatura, lanzando una corriente rápida y continua de aire sobra el cuerpo que se quema; lógrase esto, entre otros medios, con el soplete, aparato sencillo formado por un tubo metálico doblado en ángulo recto, de ramas desiguales; en el vértice del ángulo hay un depósito cilíndrico destinado a retener la saliva que se arrastra al soplar: la rama larga que se aplica a la boca termina en una boquilla de marfil. Este instrumento de gran utilidad en Química, lo es aún más en Mineralogía, a cuya ciencia corresponde más particulannente su descripción y manejo. Con un soplete formado por una corriente de gas del alumbrado alimentada por otra de oxígeno se puede producir una combustión con la cual se ha conseguido fundir el platino.
35. Acción del oxígeno sobre la vida animal y vegetal. -Hemos dicho que el oxígeno es necesario para la vida y en efecto penetrando en el aparato respiratorio (pulmones) produce según la opinión de Lavoisier una verdadera combustión quemando o combinándose con el carbono e hidrógeno excedentes de la sangre venosa o impura convirtiendola en arterial o sangre vital; de modo que se forma ácido carbónico y agua. Los autores modernos no admiten estas trasformaciones, sino que suponen que el ácido carbónico y el agua se hallan formados en la sangre venosa y que el oxígeno no hace más que reemplazarlos, no sólo en el aparato respiratorio, sino en todos los órganos. Sea de ello lo que quiera, es lo cierto que penetrando en el acto de la inspiración aire (oxígeno y nitrógeno) salen en la espiración ácido carbónico y agua en vapor. Demuéstrase la salida del ácido carbónico soplando por medio de un tubo en una disolución de cal en el agua y se ve al líquido de claro y cristalino ponerse turbio y depositarse un polvo de carbonato de cal.
Los animales acuáticos, como los peces, respiran el oxígeno que el agua tiene en disolución, el cual extraen por medio de su aparato respiratorio llamado branquias.
También los vegetales necesitan respirar: sus partes verdes como las hojas, durante el día absorben el ácido carbónico del aire y le descomponen, apropiándose el carbono y dejando en libertad el oxígeno que vuelve a enriquecer la atmósfera que lo había perdido por la respiración de los animales; durante la noche absorven oxígeno y exhalan ácido carbónico: otro tanto hacen las partes coloreadas, así de día como de noche.
Lo particular en estos fenómenos es que siendo mucho mayor la cantidad de nitrógeno que hay en el aire que la de oxígeno, no se conozca aún el papel que aquel representa en el aire y por consecuencia qué acción ejerce en la respiración, pues indudablemente ejerce alguno.
Hidrógeno. Agua.
LECCIÓN 5.ª Hidrógeno. -Propiedades. -Obtención. -Aplicaciones. -Agua. -Propiedades. -Destilación. -Análisis y síntesis del agua. -Agua oxigenada.
-I-
36. Hidrógeno. H. -Dícese que la existencia de este cuerpo fue sospechada por Paracelso95 a principios del siglo XVI; pero quien le dio a conocer y estudió sus propiedades fue Cavendish96 en 1777. Se llamó en un principio aire inflamable; pero en la nueva nomenclatura se lo dio el nombre de hidrógeno (del griego idoor agua y ginomai engendrar)
A. Propiedades. -Es gaseoso a la temperatura y presión ordinarias, pero el mismo Pictes que liquidó el oxígeno, logró, bajo una presión de 650 atmósferas y temperatura de 140 liquidar y solidificar el hidrógeno. Es incoloro, inodoro e insípido; es el cuerpo más ligero de todos, pues pesa 14'44 veces menos que el aire, siendo su densidad comparada con la de este fluido, de 0'0692. Es muy poco soluble en el agua; este líquido sólo disuelve
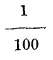
de su volumen de hidrógeno; conduce muy bien el calor y la electricidad. No sirve para la combustión, pero él arde; es decir, que es combustible, pero no comburente; una cerilla encendida que se introduzca en una campana que contenga hidrógeno, el gas arde, pero la cerilla se apaga, la que debe sacarse rápidamente de la campana, pues de lo contrario la llama, del gas vuelve a encenderlo. El producto de la combustión del hidrógeno es agua; para demostrarlo, se inflama el hidrógeno que se desprenda por el extremo de un tubo cubierto con una campana y se verá llenarse sus paredes de gotas de agua. No sirve para la respiración, pero no porque sea deletéreo o venenoso, sino porque no puede convertir la sangre venosa en arterial: los animales que le respiran mueren por asfixia (del griego a sin y sfixis pulso).
Mezclando un volumen de hidrógeno y 5 de aire e inflamada la mezcla, se produce una explosión, rompiendo la vasija; si la mezcla detonante se hace con dos volúmenes de hidrógeno y uno de oxígeno, colocados en una vejiga con llave y mechero de latón y se comprime la vejiga haciendo caer el chorro en una disolución de jabón, pues en un mortero o almirez de hierro, aproximando una cerilla encendida a las burbujas que se forman, arden con violenta detonación. Si el dardo de un soplete de gas oxígeno e hidrógeno se dirige sobre un trozo de magnesia, le calienta hasta el rojo blanco, produciendo una luz brillantísima, llamada luz de Drumond; y en fin, si se inflama el hidrógeno que se desprende por un tubo vertical terminado en punta y se cubre con otro de cristal abierto por ambos extremos, la llama se alarga hasta hallarse más alta que el orificio de salida del gas y se oye una serie de sonidos graves o agudos, resultado de las vibraciones de la llama y el aire, según sea el diámetro del tubo y que se baje o suba más o menos: esta experiencia se llama armónica química.
Las propiedades químicas que posee este gas, algunas de ellas muy singulares, han sido causa de la gran importancia que en la Química actual se concede al hidrógeno. Una de las propiedades más notables de este cuerpo, es la facilidad con que penetra en el interior de los metales fijándose en ellos. Grahan, químico inglés dice que el paladio absorve 982 veces su, volumen de gas hidrógeno y considera este compuesto como una verdadera aleación, por esta y otras razones, se considera al hidrógeno como un metal.
Hállase el hidrógeno profusamente esparcido en la naturaleza: entra en la composición del agua formando las dos terceras partes de su volumen, se halla en los carburos de hidrógeno muy abundantes y en todas las sustancias orgánicas.
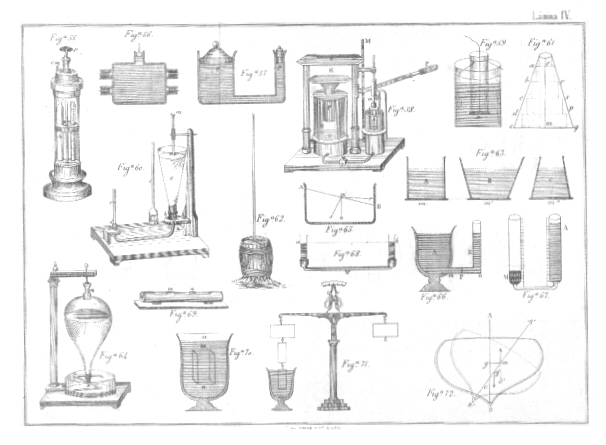
B. Obtención. -Se extrae el hidrógeno del agua, por la acción que tienen ciertos metales de descomponerla, ya en frío, ya al calor rojo, apoderándose del oxígeno y dejando en libertad el hidrógeno. El procedimiento más fácil y breve para obtenerlo, consiste en poner en un frasco bitubulado (fig. 3) granalla de zinc, en una de las bocas un tubo recto, terminado en embudo, por donde se ha de verter agua acidulada con ácido sulfúrico o bien se coloca antes el agua y se vierte poco a poco el ácido por el tubo que sirve al mismo tiempo de tubo de seguridad; y en la otra boca se fija un tubo abductor que conducirá el gas a una campana colocada en la cuba hidroneumática. Tan pronto como el ácido y el agua se hallan en contacto del zinc, comienza la reacción que según la teoría dualística, el agua se descompone, su oxígeno se combina con el zinc y forma óxido de zinc, que con el ácido sulfúrico, sulfato de zinc y el hidrógeno se desprende.
Zn+S 03 + H 0 = Zn0, S03 + H
Según la teoría unitaria, siendo el ácido sulfúrico un compuesto de hidrógeno azufre y oxígeno, el zinc reemplaza al hidrógeno, formándose como en el caso anterior, sulfato de zinc e hidrógeno libre
H S 04 + Zn = Zn S 04 + H
El hidrógeno así obtenido no es puro, porque no lo es el zinc del comercio que se emplea para este objeto, pues contiene carbono, azufre, arsénico y fósforo, cuyos cuerpos con el hidrógeno forman compuestos gaseosos pero se purifica haciendo pasar el gas por tubos en forma de U, que contengan potasa, cloruro mercúrico, nitrato de plata y acetato de plomo. Es preferible y así se hace cuando hay que obtenerlo muy puro para ciertos análisis, emplear el zinc purificado y el agua y ácido sulfúrico químicamente puros.
C. Aplicaciones. -Son muchos e importantes: para obtener los globos acrostáticos, para obtener la luz de Drumond. y reducir los óxidos.
El hidrógeno se combina con el oxígeno y da origen a dos compuestos, el protóxido de hidrógeno o agua común y el bióxido de hidrógeno o agua oxigenada.
-II-
37. Agua.-H2 O. -En tres estados se presenta en la naturaleza sólida formando la nieve, el hielo, granizo y escarcha; liquida en los mares, ríos, etc. y en el estado de vapor en la atmósfera.
A. Propiedades. -En el estado líquido es incolora, inodora e insípida; se solidifica a 0º y hierve a 100. Colocada en una elevada temperatura se descompone, así como también por la electricidad y la acción de muchos cuerpos simples como el carbón, el hierro etc. que se combinan con el oxígeno, excepto el cloro y algún otro, que al descomponer el agua, en condiciones dadas, se apodera del hidrógeno. Es curioso lo experimentado por Grove que descompuso el agua haciendo pasar su vapor por un tubo de platino incandescente; y Saint Claire Devilie (Enrique) la descompuso en parte haciendo pasar el vapor de agua por un tubo de porcelana calentado hasta 1300 grados.
El agua no se encuentra pura en la naturaleza; la que más se aproxima a la pureza es la de lluvia, recogiéndola directamente de las nubes y algún tiempo después que está lloviendo, porque las primeras porciones arrastran muchas impurezas de la atmósfera. Según las sustancias que contienen y que sirvan o no para los usos de la vida, se dividen las aguas en dulces o potables y crudas o no potables. Es dulce o potable un agua cuando es limpia, diáfana, inodora e insípida, disuelve el jabón sin producir grumos y cuece bien las legumbres. Es cruda o no potable si corta el jabón sin disolverle y no cuece las legumbres; lo cual proviene de que las materias calizas y magnésicas que estas aguas contienen se depositan al evaporarse el agua, en el tejido de la legumbre y combinándose con un principio llamado legumina forma un compuesto insoluble: El agua sin embargo no será potable porque sea muy pura y pues es preciso que contenga aire y alguno corta cantidad de sustancias salinas en la proporción de unos 5 centígr. por litro.
Si la materia que predomina en las aguas es el yeso (sulfato de calcio) se llaman selenitosas y si bicarbonato de calcio, calizas.
Si las aguas contienen principios que ejerzan una acción benéfica en el organismo, pudiendo emplearse en la curación o alivio de determinadas dolencias, entonces reciben el nombre de medicinales o minerales, que según los principios que en ellas dominan o las minenilizan, así se llaman sulfurosas, carbónicas, salinas, ferruginosas, siendo unas y otras termales o calientes y frías.
38. Destilación. -El agua es de un uso frecuentísimo en Química, pero es preciso usarla casi siempre pura y no hallándose en ese estado en la naturaleza, se la purifica por medio de la operación llamada destilación y los aparatos en que se verifica se conocen con el nombre de alambiques o alquitaras. Consta un alambique (fig. 4) 1.º de una caldera A de cobre estañado en su interior llamada cucúrbita colocada en un hornillo, en la que se pone el agua; 2.º de una cubierta C, denominada capitel que lleva un tubo lateral que comunica con otro R en forma de espiral, llamado serpentin o refrigerante que se halla dentro de un baño de agua fría Calentada el agua hasta la ebullición, los vapores pasan al, serpetin donde se condensan y en el estado líquido sale por el extremo inferior del tubo. Las primeras porciones no se aprovechan porque arrastran las sustancias volátiles que pudiera contener el agua; ni debe apurarse demasiado la destilación, porque descomponiéndose al final de la operación las sustancias fijas, irían sus productos con el vapor de agua.
Suele acompañar al alambique una pequeña caldera llamada baño de maría que se introduce en la cucúrbita, que tiene agua, quedando suspendida en su cuello y sirve para las sustancias que no han de sufrir más temperatura que 100º, es decir la del punto de ebullición del agua de la cucúrbita. Conócese que el agua es destilada, cuando además de no presentar carácter ninguno con los reactivos de que hablaremos, evaporada una porción en una hoja de platino, no deja en ella huella ni sombra alguna de materia extraña, permaneciendo limpia y brillante como antes.
Otros aparatos destilatorios se emplean según los líquidos que se quieren purificar o separar de otros y, cuyo punto de ebullición sea muy diferente; tal es el alambique de Salleron para destilar el alcohol y conocer así su riqueza alcohólica.
Reconócese la presencia en el agua de algunas de las sustancias extrañas más importantes, del modo siguiente. 1.º el ácido carbónico con el agua de cal o de barita: 2.º los cloruros con el nitrato de plata: 3.º las sales de calcio con el oxalato amónico: 4.º las sales metálicas con el sulfhidrato amónico y las sustancias orgánicas con el bicloruro de mercurio.
39. Análisis y síntesis del agua. -Este líquido fue considerado como un elemento o sustancia simple desde la época de Aristóteles hasta fines del siglo XVIII, en que se conoció su naturaleza formada por dos volúmenes de hidrógeno y uno de oxígeno.
Por los dos procedimientos, el analítico y el sintético, se confirma la composición del agua.
A. Análisis. -Son varios los métodos analíticos: citaremos tan solo dos.
1.º Por la electricidad. Haciendo pasar una corriente eléctrica a través del agua en el aparato conocido ya por Física, llamado Voltámetro.
2.º Por la acción del hierro. Haciendo penetrar una corriente de vapor de una cantidad dada de agua por el extremo de un tubo de porcelana que en su interior tiene hierro metálico que se calienta hasta el rojo en un hornillo rectangular: el hierro fija el oxígeno y el hidrógeno sale por el otro extremo y se recoge en una campana. Pesado el hierro antes y después de la operación y lo mismo el hidrógeno recogido, se tiene el paso de los gases que forman una cantidad determinada de agua.
B. Síntesis. -Haremos mención de otros dos métodos sintéticos.
1.º Por la acción del hierro. Se hace pasar una corriente de hidrógeno, puro y seco al traves del óxido de hierro colocado en un tubo de vidrio poco fusible y calentado: el hidrógeno se apodera del oxígeno y forma agua que en vapor sale por el extremo opuesto, del tubo, se condensa, recoge y pesa; pesando del mismo modo el hierro que queda, se deduce el del oxígeno que se combinó con el hidrógeno y de la diferencia entre el peso del agua recogida y el del oxígeno se deduce el del hidrógeno.
2.º Por el eudiómetro. El usado, generalmente consiste en un cilindro grueso de vidrio C (fig. 5) provisto en sus bases de guarniciones metálicas con dos llaves L L'. En m lleva una esferita de latón con una varilla colocada en frente de otra en el interior y entre las que ha de saltar la chispa eléctrica que va, a determinar la combinación: en la parte superior se atornilla un tubo T graduado: por fin hay otro tubo más pequeño llamado medidor M. Lleno el cilindro y el tubo T de. agua y colocado sobre el puente de la cuba hidroneumática, se abre la llave inferior L y se hace pasar por la base B por medio del medidor abriendo la corredera metálica C que lleva en la boca, 100 volúmenes de hidrógeno y luego otros 100 de oxígeno; haciendo saltar la chispa sobre la esfera m, se produce la combinación acompañada de una ligera sacudida y una luz en el interior, desapareciendo 150 volúmenes que se convirtieron en agua, pues si se abre la llave superior L', el agua del tubo T desciende y pasan a él 50 volúmenes de un gas que analizado resultará que es oxígeno; luego el agua está formada por 50 volúmenes de oxígeno y 100 de hidrógeno o 1 y 2.
Ahora fácil es determinar el peso de los gases que forman el agua, toda vez que se conocen sus densidades, pues la relación entre éstas es igual a la de los pesos

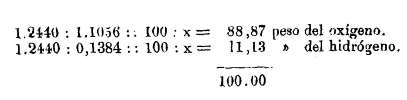
C. Aplicaciones. -Quizás no haya un cuerpo que ofrezca más usos y aplicaciones que el agua; es casi tan indispensable para la vida como el aire y sus aplicaciones en el estado sólido como en el de líquido y vapor, a la industria, a las artes, a la agricultura y a las ciencias en general, son numerosísimas y de la mayor importancia.
40. Bióxido de hidrógeno. H O2. -Se halla formado por 1 átomo de hidrógeno y 2 de oxígeno, por cuya razón se llama agua oxigenada. Es líquido, incoloro e inodoro, de un sabor picante algo metálico, consistencia de jarabe; su densidad es 1452. Es un cuerpo poco estable, pues a los 20º se descompone; es muy oxidante. Se prepara tratando el bióxido de bario por el ácido clorhídrico, con ciertas precauciones.
Ba 02 + H Cl = Ba Cl + H 02
Una aplicación importante se ha hecho del agua oxigenada, para restaurar los cuadros antiguos al óleo, cuando se han ennegrecido por las emanaciones sulfhídricas, que obrando sobre el albayalde (carbonato de plomo) forma un sulfuro de plomo negro; tratado por el agua oxigenada el sulfuro se trasforma en sulfato de plomo, blanco.
Nitrógeno. -Aire
LECCIÓN 6.ª -Nitrógeno. -Propiedades. -Obtención. -Aire. -Propiedades. -Análisis del aire. -El aire es una mezcla. -Combinaciones del nitrógeno con el oxígeno. -Protóxido y bióxido de nitrógeno. -Ácido hiponítrico.
-I-
41. Nitrógeno. N. -Descubierto por Rutheford, en 1772, y estudiado por Lavoisier en 1775. Se llamó en un principio mofela atmosférica y en la nomenclatura francesa azoe (del griego a y zoos viviente) por que no sirve para la vida: denominación impropia porque hay otros gases que tienen la misma propiedad. Hoy casi todos los químicos le llaman nitrógeno (engendrador del nitro.)
A. Propiedades. -Es gaseoso, incoloro, inodoro e insípido: densidad 0'972: el agua disuelve 0'16 de su volumen de nitrógeno. No sirve para la combustión ni para la respiración. No se combina directamente con el oxígeno, pero si los dos gases están húmedos, una serie de chispas eléctricas puede determinar su combinación; tal es el origen del ácido nítrico que se forma en las tempestad y que acompaña a las primeras gotas de lluvia que caen de las nubes eléctricas.
No existe puro en la naturaleza, pero sí abundante mezclado con el oxígeno, formando las
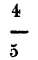
partes del aire; en todos los nitratos y en muchas sustancias orgánicas.
B. Obtención. -Se prepara calentando en una retorta de vidrio el nitrito de amoniaco.
H3 N, N 03 H 0 = 4H 0 + N2
42. Aire atmosférico. -Sospechada por Juan Rey97 en 1630 la composición del aire, fue comprobada por Lavoisier en 1774, dejando desde entonces de ser considerado como un elemento.
A. Propiedades. -Es gaseoso, sin olor ni sabor y sin color en pequeñas masas: su densidad es 1'0; muy mal conductor del calor y la electricidad. Hállase formado por la mezcla de varios gases constantes y diversas sustancias accidentales o en cantidades diferentes: los gases que constantemente forman el aire son el oxígeno y el nitrógeno, en cantidades fijas; contiene además de 4 a 10 milésimas de ácido carbónico y cantidades variables de vapor de agua: las sustancias accidentales son el ozono, ácido nítrico, carbonato de amoniaco etcétera, y gérmenes de animales y vegetales microscópicos.
43. Análisis del aire. -Desde las experiencias de Lavoisier para conocer la naturaleza del aire, se han ideado diversos procedimientos para determinar su composición. Citaremos los dos más conocidos.
1. Análisis eudiométrico. -Puede usarse el endiómetro empleado para el análisis del agua (fig. 5), poniendo en él 100 volúmenes de aire puro, es decir, privado de ácido carbónico y agua y 100 de hidrógeno; se hace saltar la chispa eléctrica; entonces abriendo la llave superior, el resto de los gases, no combinados, pasará al tubo graduado y se verá que son 137, habiendo desaparecido 63 volúmenes que se convirtieron en agua y como ésta se halla formada por dos volúmenes de hidrógeno y uno de oxígeno, de los 63, corresponden 42 al hidrógeno y 21 al oxígeno; y puesto que de los 100 volúmenes de aire colocados en el endiómetro, ha desaparecido todo el oxígeno, el resto, o sea 79, son de nitrógeno.
2. Análisis por el cobre. -Débese este método a Dumas98 y Boussingault y está fundado en la fijación del oxígeno por el cobre enrojecido. El aparato usado a este efecto consiste (fig. 6) en un globo de vidrio A con llave B, en el cual se ha hecho el vacío y pesado, y está unido por un pequeño tubo con llave C a otro de mayor diámetro poco fusible T que en su interior lleva torneaduras de cobre y se halla colocado sobre un hornillo de palastro de hierro cuyo tubo previamente se ha pesado también; éste a su vez está enlazado a otro con llave D y a continuación dos tubos E F en forma de U, que contienen amianto o piedra pómez empapada de ácido sulfúrico; luego un aparato L de bolas de Liebig99 que contienen potasa cáustica y por fin otros tres tubos O, P, R también de forma de U, con piedra pómez y ácido sulfúrico, el último de los cuales se pone en comunicación con el depósito de aire que se va a ensayar. Dispuesto todo, se enrojece el tubo y las torneaduras de cobre y se abre poco a poco la llave del tubo, entonces el aire por su expansibilidad pasa por los tubos R, P, D, donde deja el agua que absorbe el ácido sulfúrico, atraviesa por el aparato de las bolas donde deposita el ácido carbónico y pasa por los tubos F E en los cuales se despoja del agua que pudo haber tomado de la potasa, penetrando seco y sin ácido carbónico en el tubo de porcelana, donde el cobre se apodera del oxígeno, pasando al globo de vidrio el nitrógeno. Terminada la operación, se pesa el tubo y la diferencia de peso dará el del oxígeno que se unió al cobre; pesado asimismo el globo, la diferencia también entre el globo vacío y lleno del gas, indicará el del nitrógeno. Repetida la experiencia ha dado por resultado, que 100 partes de aire contienen.

Si se quisiera determinar la cantidad de ácido carbónico vapor de agua contenidos en un volumen de un aire determinado, se hallaría, habiendo pesado antes los tubos y aparato de bolas y pesándolos después; con estos datos y teniendo en cuenta la temperatura, la tensión del vapor y la presión, se encontrarían las cantidades de ácido carbónico y agua.
44. E1 aire es una mezcla. -Varios hechos demuestran que el aire no es una combinación, sino una mezcla; 1.º que toda combinación de gases, se verifica siempre en proporciones sencillas (24) y siendo las cantidades desiguales, hay contracción en el compuesto que resulta (25); lo cual no sucede en el aire. 2.º En toda combinación química hay siempre producción de calor y electricidad, lo que no se observa, al formarse el aire artificialmente. 3.º El agua disuelve mayor cantidad de oxígeno del aire que de nitrógeno; si fuera una combinación, el agua disolvería aire, y por consecuencia los dos gases en las proporciones en que, estuvieran combinados. 4.º El poder refringente de un cuerpo compuesto gaseoso es siempre mayor o menor que el de la suma de los elementos que le forman; en el aire es igual y 5.º Si fuera una combinación no será posible que tan fácilmente se separase el oxígeno en el acto de penetrar en los pulmones para la respiración.
-II-
45. Combinaciones del nitrógeno con el oxígeno. -Se combinan estos dos gases dando origen a cinco compuestos, dos óxidos el protóxido y el bióxido de nitrógeno y tres ácidos el nitroso, el hiponítrico y el nítrico.
46. Protóxido de nitrógeno. -N O. -Descubierto por Priestley en 1776.
A. Propiedades. -Es un gas a la temperatura y presión ordinaria, incoloro, inodoro y de un sabor ligeramente azucarado. A 0º y 30 atmósferas de presión se liquida y al evaporarse, tomando calor de su misma masa, que hace latente, produce, un frío que le solidifica en una masa cristalina. Es comburente; una cerilla con un punto en ignición arde con luz viva en una atmósfera de este gas; obra sobre el sistema nervioso produciendo la insensibilidad, causando antes, según algunos autores una especie de risa convulsiva, por lo cual se ha llamado este cuerpo gas hilarante.
B. Obtención. -Obtiene calentando en una retorta de vidrio el nitrato de amoniaco:
H3 N, H O, N O5 = 4 H O + 2 N O
C. Aplicaciones. -Alguna vez se usa, por los dentistas como anestésico.
47. Bióxido de nitrógeno. -N O2. -Descubierto por Hales100 en 1760.
A. Propiedades. -Es gaseoso e incoloro: otras de sus propiedades no ha sido posible apreciarlas, por que tan pronto como se pone en contacto del aire absorbe oxígeno y se trasforma en el ácido en ácido nitroso según unos, y en ácido hiponítrico según otros, dando vapores rojos: es absorbido las disoluciones de las sales ferrosas.
B. Otención. -En el frasco bitubulado de la fig. 3, se ponen torneaduras de cobre y un poco de agua y vertiendo ácido nítrico por el embudo, inmediatamente empieza la reacción y el bióxido de nitrógeno que se produce en contacto del oxígeno del aire del frasco se trasforma en vapores nitrosos rojos, hasta que consumido el oxígeno aparece el gas incoloro.
3 Cu + 4 N O5 H O = Cu O, N O5 + H O + N O2
48. Ácido hiponítrico N O5. -Descubierto cuando el ácido nítrico, pero no conocida su naturaleza hasta la época de Gay Lusac.
A. Propiedades. -Líquido a la temperatura ordinaria, de color amarillo rojizo: hierve a 22º; su densidad es de 1'45. En contacto del aire da vapores pardo-anaranjados,
B. Obtención. -Descomponiendo por la acción del fuego el nitrato de protóxido de plomo bien seco, en una retorta de vidrio enlodada, con un recipiente rodeado de una mezcla frigorifica:
Pb O, N O5 = Pb O + O + N O4
LECCIÓN 7.ª Ácido nítrico. -Propiedades. -Preparación. -Aplicaciones. Compuestos de nitrógeno e hidrógeno. -Amoniaco. -Propiedades. -Preparación. -Aplicaciones.
49. Ácido nítrico. -Fue descubierto este ácido por Raimundo Lulio101 calentando una mezcla de nitro y arcilla y recibió el nombre de espíritu de nitro y más tarde en el comercio el de agua fuerte. Estudiadas y conocidas sus propiedades y composición por Cavendish, Gay Lussac y otros sabios, se lo llamó en la nueva nomenclatura ácido nítrico. Se presenta en dos estados, sólido o anhidro y líquido o hidratado.
1.º Acido nítrico anhidro. N O5. Fue descubierto por E. Saint Clair Deville.
a. Propiedades. -Es sólido, cristalizado en largos prismas romboidales incoloros; se funde a 30º y hierve a 50º y a una temperatura más elevada se descompone en O + NO4. No puede conservarse aún en un tubo cerrado y en baja temperatura, porque se descompone rompiendo la vasija.
b. Obtención. -Se prepara haciendo pasar una corriente de gas cloro seco por el nitrato de plata, también desecado, puesto en un tubo en forma de U rodeado de una mezcla frigorífica
Ag O, N O5+Cl = Ag Cl + O + N O5
2º Acido nítrico hidratado. N O5 H O. -Este ácido en su mayor grado de concentración contiene un equivalente de agua y es por lo mismo monohidratado.
a. Propiedades. -Cuando puro es líquido, incoloro, de olor característico nitroso y de un sabor acre y corrosivo; es fumante, es decir, da humos en contacto del aire, porque absorbe el vapor de agua con quien tiene gran afinidad y se combina con ella: densidad 1'43; hierve a 86º y a los 50, bajo cero toma la consistencia de manteca. El calor le descompone y también la luz, coloreándose de amarillo por disolverse en él el ácido nitroso, producto de la descomposición: con ese color figura en el comercio. Enrojece fuertemente la tintura azul de tornasol y destruye la piel tiñéndola de amarillo que no desaparece hasta que se renueva la piel.
Es un oxidante sumamente enérgico: ataca a muchos metales en frío, como la plata y el cobre y le descomponen apoderándose de parte de su oxígeno algunos metaloides. El algodón sumergido en este ácido durante algunos minutos y luego bien lavado con agua destilada, se convierte en una materia muy inflamable llamada algodón, pólvora o piroxila, que tratado por el éter sulfúrico, da una sustancia de aspecto gelatinoso llamado colodión usado en la fotografía.
Puede adquirir mayor cantidad de agua, en cuyo caso sus propiedades varían algún tanto. Es un veneno muy activo.
Hállase abundante en la naturaleza en estado de combinación, formando nitratos.
B. Obtención. -Se extrae del nitrato de potasio o salitre que con ácido sulfúrico, en pesos iguales, se coloca en una retorta de vidrio (fig. 7) en la que se acomoda, un matraz de cuello largo sin tapón ninguno que sería destruido por los vapores nítricos: este matraz se pone en un baño de agua cubierto con una tela a quien refresca un chorro de agua fría. Calentada la mezcla, empieza la reacción, que da por resultado ácido nítrico que pasa, a condensarse al matraz.
K O, N O5 + (H O, S O3) = K O, H O, S O3 + N O5, H O
En la industria se obtiene en grandes cantidades, porque su consumo es considerable, sustituyendo al nitrato de potasio el de sodio, colocado en cilindros o calderas de hierro, que comunican con vasijas de barro llamadas bombones o damas-juanas. Así obtenido no es puro, pus contiene ácido nitroso y algo de ácido. sulfúrico; pero se purifica, destilándole en aparatos de vidrio con nitrato de plata, que convierte el ácido nitroso en nítrico; y nitrato de plata que forma con el sulfúrico, sulfato de bario.
C. Aplicaciones -Son muchas e interesantes. Se emplea para teñir la seda de amarillo; para el grabado en cobre o al agua fuerte, arte que se dice inventó el famoso grabador alemán Alberto Durero, que floreció a fines del siglo XV; para preparar el ácido sulfúrico y en los ensayos y análisis